题目内容
7.下列装置所示的实验不能达到目的是( )| A. | 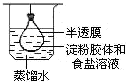 净化精制淀粉胶体 | B. |  测定化学反应速率 | ||
| C. | 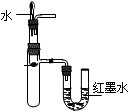 验证Na与水反应是否放热 | D. | 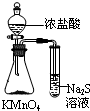 比较KMnO4、Cl2、S的氧化剂 |
分析 A.淀粉不能透过半透明,而离子可以;
B.不能用长颈漏斗;
C.根据U型管中红墨水的变化判断热量变化;
D.根据氧化还原反应氧化剂的氧化性大于氧化产物来分析.
解答 解:A.淀粉不能透过半透明,而离子可以,则利用渗析法净化、精制淀粉胶体,故A正确;
B.应用分液漏斗,如用长颈漏斗会导致生成的气体从长颈漏斗口逸散,导致实验失败,故B错误;
C.由图可知,U型管中右端红墨水高度上升,则该反应为放热反应,故C正确;
D.由氧化还原反应氧化剂的氧化性大于氧化产物可知,氧化性为KMnO4>Cl2>S,故D正确.
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离提纯、反应速率的测定、物质的性质等为解答的关键,侧重实验基本知识的考查,注意实验的评价性质分析,题目难度不大.

练习册系列答案
 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
17.乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中错误的是( )
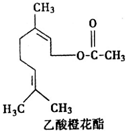

| A. | 分子式为C12H20O2 | |
| B. | 能使酸性KMnO4溶液褪色 | |
| C. | 能发生加成反应,但不能发生取代反应 | |
| D. | 1mol该有机物水解时只能消耗lmolNaOH |
18.下列有关化学概念或原理的论述中,正确的是( )
| A. | Cl2、SO2、NH3的水溶液虽都能够导电,但它们均属于非电解质 | |
| B. | 在浓硝酸中加入等体积浓硫酸后,立即加入铝片,铝片发生钝化 | |
| C. | 任何可逆反应,其平衡常数越大,反应速率、反应物的转化率就越大 | |
| D. | 电解饱和食盐水的过程中,水的电离平衡正向移动 |
19.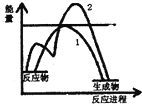 对于CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O反应有关叙述正确的是( )
对于CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O反应有关叙述正确的是( )
 对于CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O反应有关叙述正确的是( )
对于CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O反应有关叙述正确的是( )| A. | 浓硫酸在该反应中起着降低反应活化能和提高原料转化率作用 | |
| B. | 该反应属于消去反应 | |
| C. | 如图表示放热反应的图象.曲线1表示未加催化剂, 则曲线2表示加了催化剂 | |
| D. | 该反应为放热反应,故升髙温度正反应速度减小,逆反应速度加快 |
12.电解NO 制备NH4NO3,其工作原理如图所示.下列说法中正确的是( )
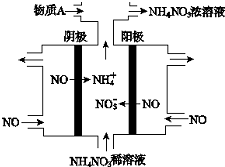

| A. | 阳极上的电极反应为:NO•3e-+4OH-=NO3-+2H2O | |
| B. | 电解生成1 mol NH4NO3 时,转移5NA电子 | |
| C. | 电解质溶液中,NO3-离子向阴极移动 | |
| D. | 为了使电解产物全部转化为NH4NO3,需补充的物质A为稀硝酸 |
13.下列有关叙述不正确的是( )
| 选项 | 已知 | 解释与结论 |
| A | 活泼金属Al、不活泼金属Cu和浓硝酸可以形成原电池 | Al作正极,Cu作负极 |
| B | 4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s) 该反应在常温下能自发进行 | 该反应的△H<0 |
| C | 常温下,Ksp(AgCl)=1.8×10-10、 Ksp(AgBr)=5.4×10-13 | 向BaCl2溶液中加入AgNO3和KBr,当AgCl、AgBr两种沉淀共存时,$\frac{c(B{r}^{-})}{c(C{l}^{-})}$=3×10-3 |
| D | 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液,振荡,溶液变为黄色 | 氧化性:H2O2>Fe3+ |
| A. | A | B. | B | C. | C | D. | D |




 .
. .
.