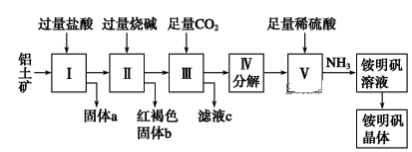
题目内容
【题目】化学在能源开发与利用中起着十分重要的作用。
(1)蕴藏在海底的可燃冰是高压下形成的外观像冰的甲烷水合物固体。2017年我国在南海北部进行的可燃冰采取试验获得成功,标志着我国成为第一个实现在海域可燃冰试开采中获得连续稳定燃气的国家。已知:25℃、101kPa下,1g甲烷完全燃烧生成CO2和液态水时放热55.6kJ。甲烷燃烧的热化学方程式为_____________。相同条件下,356g可燃冰(分子式为CH4·9H2O,Mr=178)释放的甲烷气体完全燃烧生成CO2和液态水,放出的热量为_____kJ。
(2)二甲醚(CH3OCH3)是无色气体,可作为一种新型能源,具有清洁、高效的优良性能。由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:(i)CO(g)+2H2(g) ![]() CH3OH(g)△H1=-90.1kJ/mol
CH3OH(g)△H1=-90.1kJ/mol
(ii)CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)△H2=-49.0kJ/mol
CH3OH(g)+H2O(g)△H2=-49.0kJ/mol
水煤气变换反应:(iii)CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H3=-41.1kJ/mol
CO2(g)+H2(g) △H3=-41.1kJ/mol
二甲醚合成反应:(iv)2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) △H4=-24.5kJ/mol
CH3OCH3(g)+H2O(g) △H4=-24.5kJ/mol
①分析二甲醚合成反应(iv)对于CO转化率的影响____________________。
②由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为:______________。根据化学反应原理,分析增加压强对直接制备二甲醚反应的影响__________________________。
(3)二甲醚直接燃料电池具有启动快、效率高等优点。若电解质为碱性,二甲醚直接燃料电池的负极反应为____,一个二甲醚分子经过电化学氧化,可以产生______个电子的电量。
【答案】 CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-889.6kJ/mol 1779.2 消耗甲醇,促进甲醇合成反应(i)平衡右移,CO转化率增大;生成的H2O通过水煤气变换反应(iii)消耗部分CO 2CO(g)+4H2(g) ![]() CH3OCH3(g)+H2O(g) △H=-204.7kJ/mol 该反应分子数减小,压强升高使平衡右移,CO和H2转化率增大,CH3OCH3产率增加;压强升高使CO和H2浓度增加,反应速率增大 CH3OCH3+16OH- -12e-=2CO32-+11H2O 12
CH3OCH3(g)+H2O(g) △H=-204.7kJ/mol 该反应分子数减小,压强升高使平衡右移,CO和H2转化率增大,CH3OCH3产率增加;压强升高使CO和H2浓度增加,反应速率增大 CH3OCH3+16OH- -12e-=2CO32-+11H2O 12
【解析】分析:本题考查热化学方程式的书写和反应热的计算、外界条件对化学平衡的影响、燃料电池的工作原理和计算。
(1)计算1molCH4燃烧生成CO2和液态水时放出的热量,据此写出热化学方程式;根据热化学方程式计算反应放出的热量。
(2)①二甲醚合成反应(iv)消耗CH3OH(g)同时生成H2O(g),由于CH3OH(g)浓度减小,促进甲醇合成反应(i)平衡右移,CO转化率增大;生成H2O(g)通过水煤气变换反应(iii)消耗CO;二甲醚合成反应(iv)能增大CO的转化率。
②应用盖斯定律,将(i)![]() 2+(iv)得,H2和CO直接制备二甲醚的热化学方程式。该反应的正反应为气体分子数减小的反应,增加压强,平衡向正反应方向移动,增大压强化学反应速率加快。
2+(iv)得,H2和CO直接制备二甲醚的热化学方程式。该反应的正反应为气体分子数减小的反应,增加压强,平衡向正反应方向移动,增大压强化学反应速率加快。
(3)若电解质为碱性,二甲醚发生氧化反应生成CO32-,负极电极反应为CH3OCH3-12e-+16OH-=2CO32-+11H2O。1个二甲醚分子经电化学氧化,可以产生12个电子的电量。
详解:(1)1gCH4完全燃烧生成CO2和液态水时放热55.6kJ,1molCH4完全燃烧生成CO2和液态水时放热55.6![]() 16kJ=889.6kJ,CH4燃烧的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=-889.6kJ/mol。n(CH4·9H2O)=
16kJ=889.6kJ,CH4燃烧的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=-889.6kJ/mol。n(CH4·9H2O)=![]() =2mol,356g可燃冰释放2molCH4,2molCH4完全燃烧生成CO2和液态水放出的热量为889.6kJ
=2mol,356g可燃冰释放2molCH4,2molCH4完全燃烧生成CO2和液态水放出的热量为889.6kJ![]() 2=1779.2kJ。
2=1779.2kJ。
(2)①二甲醚合成反应(iv)消耗CH3OH(g)同时生成H2O(g),由于CH3OH(g)浓度减小,促进甲醇合成反应(i)平衡右移,CO的转化率增大;生成H2O(g)通过水煤气变换反应(iii)消耗CO;二甲醚合成反应(iv)能增大CO的转化率。
②应用盖斯定律,将(i)![]() 2+(iv)得,2CO(g)+4H2(g)
2+(iv)得,2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g)ΔH=(-90.1kJ/mol)
CH3OCH3(g)+H2O(g)ΔH=(-90.1kJ/mol)![]() 2+(-24.5kJ/mol)=-204.7kJ/mol,H2和CO直接制备二甲醚的热化学方程式为:2CO(g)+4H2(g)
2+(-24.5kJ/mol)=-204.7kJ/mol,H2和CO直接制备二甲醚的热化学方程式为:2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g)ΔH=-204.7kJ/mol。该反应的正反应为气体分子数减小的反应,增加压强,平衡向正反应方向移动,CO和H2的转化率增大,CH3OCH3的产率增加;增加压强,CO和H2的浓度增大,直接合成二甲醚反应的反应速率加快。
CH3OCH3(g)+H2O(g)ΔH=-204.7kJ/mol。该反应的正反应为气体分子数减小的反应,增加压强,平衡向正反应方向移动,CO和H2的转化率增大,CH3OCH3的产率增加;增加压强,CO和H2的浓度增大,直接合成二甲醚反应的反应速率加快。
(3)若电解质为碱性,在负极二甲醚发生氧化反应生成CO32-,负极反应可写成CH3OCH3-e-→CO32-+H2O,CH3OCH

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案