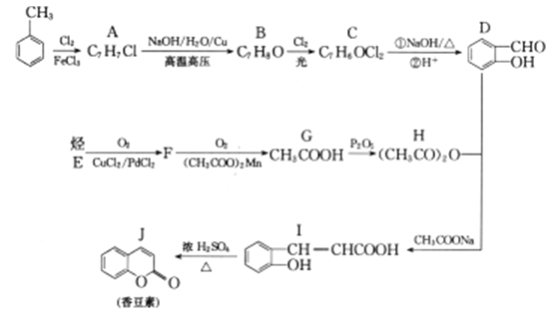
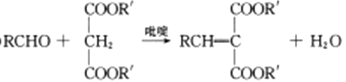
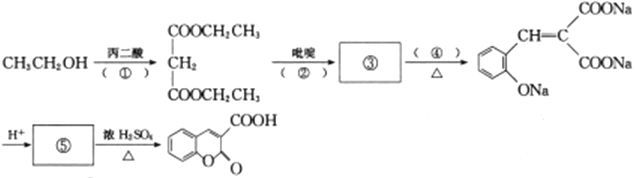
题目内容
【题目】新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2 ,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。

回答下列问题:
(1)甲烷燃料电池正极、负极的电极反应分别为________________ 、_______________ ;
(2)闭合K开关后,a、b电极上均有气体产生.其中a电极上得到的是_________(填化学式),电解氯化钠溶液的总反应方程式为___________________;
(3)若每个电池甲烷通入量为1 L(标准状况),且反应完全,则理论上最多能产生的氯气体积为____________L(标准状况);
(4)若饱和氯化钠溶液体积为100mL,电解一段时间后,常温下测得溶液pH为13,若要使溶液恢复到电解前的状态,可向溶液中加(或通)入__________(填写物质的化学式)_________g。
【答案】 ![]() CH4+10OH--8e—=
CH4+10OH--8e—=![]() +7H2O Cl2
+7H2O Cl2 ![]() 4 HCl 0.365
4 HCl 0.365
【解析】本题考查电极反应式的书写,电解原理以及电化学计算,(1)根据原电池的工作原理,通甲烷的一极为负极,通氧气一极为正极,因为电解质为KOH,因此正极反应式O2+2H2O+4e-=4OH-,负极反应式为CH4+10OH--8e-=CO32-+7H2O;(2)a连接通氧气一极,即a为阳极,根据电解原理,a电极反应式为2Cl-2e-=Cl2↑,即a极上得到Cl2;a、b电极为惰性电极,因此电解氯化钠的方程式为2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑;(3)两个燃料电池是串联,通过电子物质的量相等,依据电极反应式,建立关系式为CH4~8e-~4Cl2,产生氯气物质的量为4/22.4mol,即氯气体积为4L;(4)根据电解食盐水的总反应式,产生的是NaOH、H2、Cl2,因此恢复到电解前的状态,加入物质是HCl,溶液的pH=13,溶液中c(OH-)=Kw/c(H+)=10-14/10-13mol·L-1=10-1mol·L-1,即n(OH-)=100×10-3×10-1mol=0.01mol,需要通入HCl的质量为0.01×2×36.5/2g=0.365g。
2NaOH+H2↑+Cl2↑;(3)两个燃料电池是串联,通过电子物质的量相等,依据电极反应式,建立关系式为CH4~8e-~4Cl2,产生氯气物质的量为4/22.4mol,即氯气体积为4L;(4)根据电解食盐水的总反应式,产生的是NaOH、H2、Cl2,因此恢复到电解前的状态,加入物质是HCl,溶液的pH=13,溶液中c(OH-)=Kw/c(H+)=10-14/10-13mol·L-1=10-1mol·L-1,即n(OH-)=100×10-3×10-1mol=0.01mol,需要通入HCl的质量为0.01×2×36.5/2g=0.365g。

【题目】工业上利用电解饱和食盐水可制得重要化工产品,又称为“氯碱工业”。并能以它们为原料生产一系列化工产品。为提高原料的利用率,节能降耗。设计如图所示工艺流程,其中氯碱工业装置中的电极未标出。
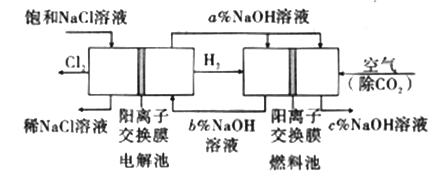
(1)电解饱和食盐水的化学方程式为___________________。
(2)为除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,得到纯净的NaCl,可将粗盐溶于水,正确的操作步骤的顺序是_______ (填序号)。
①过滤②加过量NaOH溶液③加适量盐酸④加过量Na2CO3溶液⑤加过量BaCl2溶液
A.①④①②⑤③ B.①②⑤④①③ C.①②④⑤③ D.④②⑤
(3)图中NaOH溶液的质量分数a%、b%、c%,由大到小的顺序为_________。
(4)氯碱工业的产物NaOH与不同物质反应可以生成不同的盐。已知常温下,浓度均为0.1 mol/L的四种钠盐溶液pH如下表,下列说法不正确的是_______(填序号)。
溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
pH | 11.6 | 9.7 | 10.3 | 5.2 |
A.向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度
B.四种溶液中,水的电离程度最大的是NaClO
C.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是HClO
D.四种盐的阴离子结合H+能力最强的是HCO3-
(5)若利用电解氯化钠溶液所得的气体制36.5%的浓盐酸100t,最少需要消耗食盐_________t。
(6)氯碱工业产品Cl2可用于冶炼钛铁矿得到金属钛,流程如图。写出钛铁矿经氯化法得到四氯化钛的化学方程式:____________________。
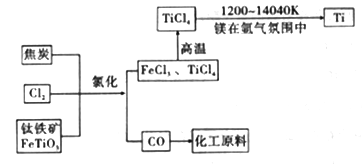
(7)氮气和氩气是两种化学性质相对稳定的气体。镁还原TiCl4的反应中为防止Mg和Ti被氧化选择稀有气体氩气。试用化学反应方程式解释不选用氮气的原因:__________________。