题目内容
【题目】前四周期元素A、B、C、D、E、F,原子序数依次增大,其中A和B同周期,固态的AB2能升华;C和E原子都有一个未成对电子,C+比E-少一个电子层,E原子得到一个电子后3p轨道全充满;D最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F为红色单质,有F+和F2+两种离子。回答下列问题:
(1)元素电负性:D____E (填>、<或=);
(2)B、C单质熔点B_____C(填>、<或=);
(3)AE4中A原子杂化轨道方式为:________杂化;其固态晶体类型为_____________;
(4)氢化物的沸点:B比D高的原因______________;
(5)F的核外电子排布式为____________________________;向F的硫酸盐中逐滴加入氨水先产生沉淀,后沉淀溶解为深蓝色溶液,加入乙醇会析出深蓝色晶体,该晶体的化学式为_______,其中关于该晶体下列说法中正确的是_____________________。
A.加入乙醇的目的是降低溶剂的极性,促使晶体析出
B.F与NH3之间的化学键为离子键
C.该配合物晶体中,N是配位原子,NH3为三角锥型
D.配离子内N原子排列成为平面正方形,则其中F离子是sp3杂化
E.向该晶体的水溶液中加入浓BaCl2溶液有白色沉淀生成
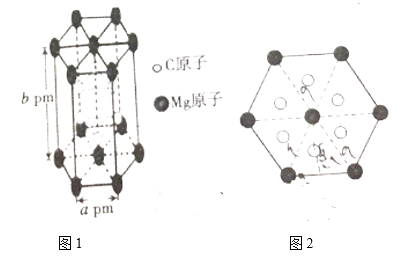
(6)元素X的某价态阴离子Xn-中所有电子正好充满K和L电子层,CnX晶体的最小结构单元为立方体,结构如图所示。该晶体中每个Xn-被________个等距离的C+离子包围。已知该晶体的密度为ρg.cm-3,阿伏加德罗常数为NA,CnX的摩尔质量为M g/mol,C+和Xn-间的最短距离是_____________nm。(列出计算式即可)

【答案】 < < sp3 分子晶体 水分子间存在氢键 [Ar]3d104s1(或1s22s22p63s23p63d104s1) [Cu(NH3)4]SO4·H2O ACE 6 ![]() ×107
×107
【解析】分析:本题考查元素的推断、电负性的比较、熔点和沸点高低的比较、原子杂化方式和晶体类型的判断、核外电子排布式的书写、配位化合物、晶胞的分析和计算。E原子得到一个电子后3p轨道全充满,E为Cl元素;C和E原子都有一个未成对电子,C+比E-少一个电子层,C为Na元素;A、B的原子序数小于C,A和B同周期,固态AB2能升华,A为C元素,B元素为O元素;设D的最高正价为+x,D最高价氧化物中D与O的个数比为2:x,D最高价氧化物中D的质量分数为40%,2Ar(D):16x=40%:60%,![]() =
=![]() ,经讨论,Ar(D)=32,x=6,D原子核内质子数等于中子数,D为S元素;F为红色单质,有F+和F2+两种离子,F为Cu元素。
,经讨论,Ar(D)=32,x=6,D原子核内质子数等于中子数,D为S元素;F为红色单质,有F+和F2+两种离子,F为Cu元素。
详解:E原子得到一个电子后3p轨道全充满,E为Cl元素;C和E原子都有一个未成对电子,C+比E-少一个电子层,C为Na元素;A、B的原子序数小于C,A和B同周期,固态AB2能升华,A为C元素,B元素为O元素;设D的最高正价为+x,D最高价氧化物中D与O的个数比为2:x,D最高价氧化物中D的质量分数为40%,2Ar(D):16x=40%:60%,![]() =
=![]() ,经讨论,Ar(D)=32,x=6,D原子核内质子数等于中子数,D为S元素;F为红色单质,有F+和F2+两种离子,F为Cu元素。
,经讨论,Ar(D)=32,x=6,D原子核内质子数等于中子数,D为S元素;F为红色单质,有F+和F2+两种离子,F为Cu元素。
(1)非金属性:Cl![]() S,元素的电负性:D(S)
S,元素的电负性:D(S)![]() E(Cl)。
E(Cl)。
(2)B的单质有O2和O3,O2、O3常温下呈气态;C的单质为Na,Na常温下呈固态;B、C单质熔点:B![]() C。
C。
(3)AE4的化学式为CCl4,中心原子C的价层电子对数为![]() (4-4
(4-4![]() 1)+4=4,C原子采用sp3杂化。CCl4固态晶体类型为分子晶体。
1)+4=4,C原子采用sp3杂化。CCl4固态晶体类型为分子晶体。
(4)B的氢化物为H2O,D的氢化物为H2S,B的氢化物(H2O)的沸点比D的氢化物(H2S)高的原因是:H2O分子间存在氢键,H2S分子间不存在氢键。
(5)F为Cu,Cu原子核外有29个电子,Cu原子核外电子排布式为1s22s22p63s23p63d104s1。向CuSO4溶液中逐滴加入氨水至沉淀完全溶解,发生的反应为CuSO4+2NH3·H2O=Cu(OH)2↓+(NH4)2SO4、Cu(OH)2+4NH3·H2O=[Cu(NH3)4](OH)2+4H2O,加入乙醇析出深蓝色晶体,该深蓝色晶体的化学式为[Cu(NH3)4]SO4·H2O。A项,加入乙醇的目的是降低溶剂的极性,促使晶体析出,A项正确;B项,Cu2+与NH3之间为配位键,B项错误;C项,该配合物中,配体为NH3,N原子上有孤电子对,N是配位原子,N提供孤电子对与Cu2+的空轨道形成配位键,NH3为三角锥型,C项正确;若Cu2+为sp3杂化,配离子内N原子排列为正四面体,D项错误;E项,SO42-在外界,该晶体溶于水电离出[Cu(NH3)4]2+和SO42-,向该晶体的水溶液中加入浓BaCl2溶液会产生白色BaSO4沉淀,E项正确;答案选ACE。
(6)根据晶胞,每个Xn-被6个等距离的C+包围。用“均摊法”,晶胞中含C+:12![]() =3,含Xn-:8
=3,含Xn-:8![]() =1,晶体的化学式为C3X,n=3;1mol晶体的质量为Mg,1mol晶体的体积为Mg
=1,晶体的化学式为C3X,n=3;1mol晶体的质量为Mg,1mol晶体的体积为Mg![]() ρg/cm3=
ρg/cm3=![]() cm3,1个晶胞的体积为
cm3,1个晶胞的体积为![]() cm3
cm3![]() NA=
NA=![]() cm3,晶胞的边长为
cm3,晶胞的边长为![]() cm,C+和Xn-间的最短距离为晶胞边长的一半,C+和Xn-间的最短距离为
cm,C+和Xn-间的最短距离为晶胞边长的一半,C+和Xn-间的最短距离为![]() cm=
cm=![]() 107nm。
107nm。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案【题目】工业上利用电解饱和食盐水可制得重要化工产品,又称为“氯碱工业”。并能以它们为原料生产一系列化工产品。为提高原料的利用率,节能降耗。设计如图所示工艺流程,其中氯碱工业装置中的电极未标出。
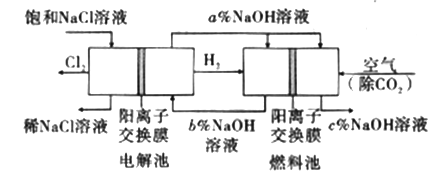
(1)电解饱和食盐水的化学方程式为___________________。
(2)为除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,得到纯净的NaCl,可将粗盐溶于水,正确的操作步骤的顺序是_______ (填序号)。
①过滤②加过量NaOH溶液③加适量盐酸④加过量Na2CO3溶液⑤加过量BaCl2溶液
A.①④①②⑤③ B.①②⑤④①③ C.①②④⑤③ D.④②⑤
(3)图中NaOH溶液的质量分数a%、b%、c%,由大到小的顺序为_________。
(4)氯碱工业的产物NaOH与不同物质反应可以生成不同的盐。已知常温下,浓度均为0.1 mol/L的四种钠盐溶液pH如下表,下列说法不正确的是_______(填序号)。
溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
pH | 11.6 | 9.7 | 10.3 | 5.2 |
A.向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度
B.四种溶液中,水的电离程度最大的是NaClO
C.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是HClO
D.四种盐的阴离子结合H+能力最强的是HCO3-
(5)若利用电解氯化钠溶液所得的气体制36.5%的浓盐酸100t,最少需要消耗食盐_________t。
(6)氯碱工业产品Cl2可用于冶炼钛铁矿得到金属钛,流程如图。写出钛铁矿经氯化法得到四氯化钛的化学方程式:____________________。
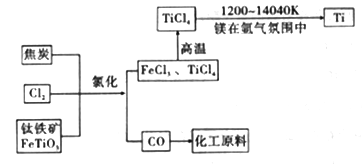
(7)氮气和氩气是两种化学性质相对稳定的气体。镁还原TiCl4的反应中为防止Mg和Ti被氧化选择稀有气体氩气。试用化学反应方程式解释不选用氮气的原因:__________________。