题目内容
【题目】将等物质的量的金属Na、Mg、Al分别与100 mL 2 mol·L-1的盐酸反应,实验测得生成气体的体积V(已折合为标准状况)与时间t的关系如图所示,则下列说法错误的是
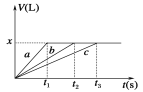
A. x=2.24 B. 铝的物质的量为0.2 mol
C. 反应时,Na、Mg、Al均过量 D. 曲线C为Al与盐酸反应的图像
【答案】C
【解析】
按照金属活动性顺序:Na>Mg>Al可知,钠是活泼的金属,极易与水反应,因此钠与盐酸的反应速率最快,而镁或铝与水不反应,只能与盐酸反应,因此a表示钠,b表示Mg,c表示Al;根据图像可知,反应中生成的氢气体积相同,所以参加反应的盐酸是相同,即金属在与盐酸反应时盐酸不足,金属过量。但过量的金属钠会继续与水反应放出氢气,所以根据方程式2Na+2HCl=2NaCl+H2↑可知钠的物质的量只能是0.1L×2mol/L=0.2mol,则镁和铝的物质的量也是0.2mol;氢气的物质的量是0.2mol÷2=0.1mol,标准状况下的体积是2.24L,据以上分析解答。
按照金属活动性顺序:Na>Mg>Al可知,钠是活泼的金属,极易与水反应,因此钠与盐酸的反应速率最快,而镁或铝与水不反应,只能与盐酸反应,因此a表示钠,b表示Mg,c表示Al。根据图像可知,反应中生成的氢气体积相同,所以参加反应的盐酸是相同,即金属在与盐酸反应时盐酸不足,金属过量。但过量的金属钠会继续与水反应放出氢气,所以根据方程式2Na+2HCl=2NaCl+H2↑可知钠的物质的量只能是0.1L×2mol/L=0.2mol,则镁和铝的物质的量也是0.2mol。氢气的物质的量是0.2mol÷2=0.1mol,标准状况下的体积是2.24L;
A.结合以上分析可知,由于酸不足,所以生成氢气的量为:n(H2)=1/2n(HCl)=0.1×2÷2=0.1mol,所以标况下的体积为2.24L,A项正确;
B.结合以上分析可知,生成0.1mol的氢气需0.2mol的钠,根据题意可知,铝的物质的量也为0.2 mol,B项正确;
C.结合以上分析可知,Na不可能过量,若Na过量会与溶剂水反应,C项错误;
D.结合以上分析可知,则反应速率最慢的为铝,用时最长,则曲线C为Al与盐酸反应的图像,D项正确;
综上所述,本题选C。

 阅读快车系列答案
阅读快车系列答案【题目】C、N、O、Na、Mg、Al、S、Cl是常见的八种元素,根据元素及其化合物性质,回答下列问题:
(1)S在周期表中的位置为______;CO2的电子式是_______。
(2)比较O、Na元素常见离子的半径大小(用化学式表示,下同)____>____;__________比较S、Cl元素的最高价氧化物对应水化物的酸性强弱:____>____ 。_______________
(3)已知:
化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是___________;制铝时,电解Al2O3而不电解AlCl3的原因是___________ 。
(4)碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的结构简式为______;Q的化学式为_______ 。
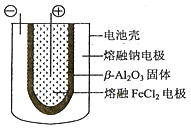
(5)熔融状态下,钠和FeCl2能组成可充电电池(装置示意图如下),反应原理为:2Na+FeCl2![]() Fe+2NaCl.放电时,电池的正极反应式为___________;充电时,_______(写物质名称)电极接电源的负极;该电池的电解质为_______。
Fe+2NaCl.放电时,电池的正极反应式为___________;充电时,_______(写物质名称)电极接电源的负极;该电池的电解质为_______。