题目内容
1. 某无色稀溶液X中,可能含有表所列离子中的某几种.
某无色稀溶液X中,可能含有表所列离子中的某几种.现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂Y体积(V)的关系如图所示,下列说法正确的是( )
| 阴离子 | CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
| A. | 若Y是盐酸,则Oa段转化为沉淀的离子(表中,下同)只有AlO2- | |
| B. | 若Y是盐酸,则溶液中可能含有的阳离子是Al3+ | |
| C. | 若Y是NaOH溶液,则bc段反应的离子方程式为 Al(OH)3+OH-═AlO2-+2H2O | |
| D. | 若Y是NaOH溶液,则X溶液中只存四种离子是:Al3+、Fe3+、NH4+、Cl- |
分析 A.若Y是盐酸,SiO32-、AlO2-与盐酸反应都会生成沉淀;
B.若Y是盐酸,ab段沉淀的物质的量不变,则盐酸与CO32-反应,结合离子共存分析;
C.若Y是NaOH溶液,bc段沉淀减少,是氢氧化铝溶于过量的氢氧化钠;
D.若Y是NaOH溶液,则不能判断溶液中是否含有Na+.
解答 解:A.若Y是盐酸,SiO32-、AlO2-与盐酸反应都会生成沉淀,所以oa段转化为沉淀的离子有AlO2-和SiO32-,故A错误;
B.若Y是盐酸,ab段沉淀的物质的量不变,则盐酸与CO32-反应,所以溶液中一定有CO32-,CO32-与Al3+不能共存,所以不含有Al3+,故B错误;
C.若Y是NaOH溶液,bc段沉淀减少,是氢氧化铝溶于过量的氢氧化钠,则发生反应的离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,故C正确;
D.若Y是NaOH溶液,则不能判断溶液中是否含有Na+,所以溶液中可能还有Na+,故D错误.
故选C.
点评 本题考查了离子之间的反应,根据图象分析出有哪些离子之间发生反应,结合离子共存来分析解答,题目难度中等,注意把握常见离子之间的反应.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
11. 向一定量的硫酸、硫酸铝、硫酸铁的混合溶液中逐滴加入NaOH溶液,生成沉淀量随NaOH溶液加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )
向一定量的硫酸、硫酸铝、硫酸铁的混合溶液中逐滴加入NaOH溶液,生成沉淀量随NaOH溶液加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )
 向一定量的硫酸、硫酸铝、硫酸铁的混合溶液中逐滴加入NaOH溶液,生成沉淀量随NaOH溶液加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )
向一定量的硫酸、硫酸铝、硫酸铁的混合溶液中逐滴加入NaOH溶液,生成沉淀量随NaOH溶液加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )| A. | a点对应的溶液:NH4+、Fe2+、Cl-、NO3- | |
| B. | b点对应的溶液:K+、Cl-、SCN-、MnO4- | |
| C. | c点对应的溶液:K+、Fe2+、Br-、NO3- | |
| D. | d点对应的溶液:Ba2+、HCO3-、Cl-、NO3- |
12.可逆反应CO(g)+H2O(g)$\stackrel{△}{?}$ CO2(g)+H2(g),达到平衡后,有关化学反应限度的说法正确的是( )
| A. | V正=0 | B. | V逆=0 | C. | V正=V逆≠0 | D. | V正=V逆=0 |
16.下列解释实验事实的方程式正确的是( )
| A. | CuSO4溶液中加入过量氨水得到深蓝色溶液:Cu2++2OH-═Cu(OH)2↓ | |
| B. | 碳酸钠溶液中滴入酚酞试液,溶液变红:CO32-+2H2O?H2CO3+2OH- | |
| C. | FeCl2溶液中加入K3[Fe(CN)6]溶液,生成蓝色沉淀:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓ | |
| D. | 90℃时,测得纯水pH=6.7,pH<7的原因是:H2O(l)?H+(aq)+OH-(aq)△H<0 |
13.向3支盛有少量Mg(OH)2沉淀的试管中分别滴加适量的蒸馏水,盐酸和氯化铵溶液,观察并记录现象,并写出实验中有关反应的化学方程式.
| 滴加试剂 | 蒸馏水 | 盐酸 | 氯化铵溶液 |
| 现象 |
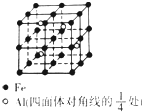 某宝石的主要成分是Al2O3,其中混有少量Mg、Ti、Fe等杂质而使其呈蓝色.
某宝石的主要成分是Al2O3,其中混有少量Mg、Ti、Fe等杂质而使其呈蓝色.