题目内容
19.W、X、Y、Z是四种短周期元素,X、Y处于同一周期,X的主族序数是周期序数的2倍,Y2-、Z+、W3+的电子层结构相同,下列说法正确的是( )| A. | 原子序数:W>X>Y>Z | B. | 原子半径:Z>W>X>Y | ||
| C. | 离子半径:W3+>Y2->Z+ | D. | 单质沸点:W>X>Y>Z |
分析 W、X、Y、Z是四种短周期元素,Y2-、Z+、W3+的电子层结构相同,则Y处于第二周期,Z、W处于第三周期,结合离子电荷,可知Y为O元素、Z为Na、W为Al,X、Y处于同一周期,X的主族序数是周期序数的2倍,即处于ⅣA族,故X为C元素,据此解答.
解答 解:W、X、Y、Z是四种短周期元素,Y2-、Z+、W3+的电子层结构相同,则Y处于第二周期,Z、W处于第三周期,结合离子电荷,可知Y为O元素、Z为Na、W为Al,X、Y处于同一周期,X的主族序数是周期序数的2倍,即处于ⅣA族,故X为C元素.
A.原子序数Al>Na>O>C,故A错误;
B.同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径:Na>Al>C>O,故B正确;
C.电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:O2->Na+>Al3+,故C错误;
D.常温下氧气为气体,其它为固体,故氧气沸点最低,故D错误,
故选B.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重对元素周期律的考查,难度不大.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
4.下列叙述正确的是( )
| A. | 苯与溴水混合可发生加成反应 | |
| B. | 蛋白质和油脂都属于高分子化合物,一定条件下都能水解 | |
| C. | 煤的干馏可以得到苯、甲苯和二甲苯 | |
| D. |  命名为2-甲基-3-戊烯 命名为2-甲基-3-戊烯 |
10.X、Y、M、N是短周期主族元素,且原子序数依次增大.已知X原子的最外层电子数是电子层数的3倍,X、M同主族,Y原子在短周期主族元素中原子半径最大.下列说法正确的是( )
| A. | Y2X和Y2X2中化学键类型相同,阴、阳离子的个数比相同 | |
| B. | 气态氢化物的热稳定性:M>N | |
| C. | M与X的化合物对应的水化物一定是强酸 | |
| D. | 离子半径r:r(X2-)>(r+) |
7.下列离子能大量共存的是( )
| A. | 含大量 H+的溶液中:CrO42-、Cl-、N03-、Na+ | |
| B. | 含大量 A102-的溶液中:Na+、K+、NO3-、HCO3- | |
| C. | 含大量 Al3+的溶液中:K+、Na+、NO3-、Cl0- | |
| D. | 含大量 CH3COO- 的溶液中:NH4+、Cl-、F-、K+ |
11. 向一定量的硫酸、硫酸铝、硫酸铁的混合溶液中逐滴加入NaOH溶液,生成沉淀量随NaOH溶液加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )
向一定量的硫酸、硫酸铝、硫酸铁的混合溶液中逐滴加入NaOH溶液,生成沉淀量随NaOH溶液加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )
 向一定量的硫酸、硫酸铝、硫酸铁的混合溶液中逐滴加入NaOH溶液,生成沉淀量随NaOH溶液加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )
向一定量的硫酸、硫酸铝、硫酸铁的混合溶液中逐滴加入NaOH溶液,生成沉淀量随NaOH溶液加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )| A. | a点对应的溶液:NH4+、Fe2+、Cl-、NO3- | |
| B. | b点对应的溶液:K+、Cl-、SCN-、MnO4- | |
| C. | c点对应的溶液:K+、Fe2+、Br-、NO3- | |
| D. | d点对应的溶液:Ba2+、HCO3-、Cl-、NO3- |
8.通常状况下能共存,且能用碱石灰干燥的一组气体是( )
| A. | H2,N2,SO2 | B. | H2,N2,O2 | C. | HCl,NO2,NH3 | D. | O2,NO2,NO |

 ;水杨酸与小苏打溶液反应的化学方程式:
;水杨酸与小苏打溶液反应的化学方程式: ; 一定条件下,C与F反应的反应类型是_酯化反应.
; 一定条件下,C与F反应的反应类型是_酯化反应. .
. .
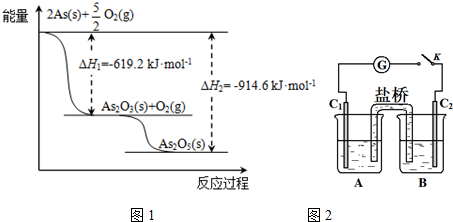
.
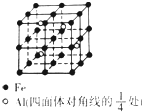 某宝石的主要成分是Al2O3,其中混有少量Mg、Ti、Fe等杂质而使其呈蓝色.
某宝石的主要成分是Al2O3,其中混有少量Mg、Ti、Fe等杂质而使其呈蓝色.