题目内容
19.工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2.在该反应中( )| A. | 硫元素既被氧化又被还原 | |
| B. | 氧化剂与还原剂的物质的量之比为1:2 | |
| C. | 每生成1molNa2S2O3,转移4mol电子 | |
| D. | 相同条件下,每吸收10m3SO2就会放出2.5m3CO2 |
分析 工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2,其反应方程式为2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2,反应在S元素的化合价从-2价升高到+2价,S的化合价从+4价降低到+2价,据此分析.
解答 解:A.由反应方程式中S元素的化合价变化可知,硫元素既被氧化又被还原,故A正确;
B.2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2中,Na2S为还原剂,SO2为氧化剂,则氧化剂与还原剂的物质的量之比为2:1,故B错误;
C.反应中2Na2S转化为3Na2S2O3,转移8个电子,则生成1molNa2S2O3,转移$\frac{8}{3}$mol电子,故C错误;
D.根据方程式可知,每当4molSO2参与氧化还原反应就会放出1molCO2,则每10m3SO2参与反应就会放出2.5m3CO2,由于二氧化碳溶于水,所以产生的二氧化碳少于2.5m3,故D正确.
故选AD.
点评 本题考查了氧化还原反应,注意根据反应物和生成物写出反应方程式,结合元素化合价的变化分析,题目难度中等.

练习册系列答案
相关题目
7.二氧化硫能使溴水褪色,说明二氧化硫具有( )
| A. | 还原性 | B. | 氧化性 | C. | 漂白性 | D. | 酸性 |
14. 研究电化学腐蚀及防护的装置如图所示.下列有关说法错误的是( )
研究电化学腐蚀及防护的装置如图所示.下列有关说法错误的是( )
 研究电化学腐蚀及防护的装置如图所示.下列有关说法错误的是( )
研究电化学腐蚀及防护的装置如图所示.下列有关说法错误的是( )| A. | d为石墨,铁片腐蚀加快 | |
| B. | d为石墨,石墨上电极反应为:O2+2H2O+4e-=4OH- | |
| C. | d为锌块,铁片不易被腐蚀 | |
| D. | d为锌块,铁片上电极反应为:2H++2e-→H2↑ |
7.将一定量铁粉和铜粉的混合物加入由稀硫酸和稀硝酸组成的混合溶液中,充分反应后金属粉末有剩余,下列有关推断正确的是( )
| A. | 反应过程中不可能产生H2 | |
| B. | 剩余的金属粉末中一定有铜 | |
| C. | 往反应后的溶液中加入KSCN 溶液会变血红色 | |
| D. | 往反应后的溶液中加入足量的稀H2SO4,则金属粉末的质量一定会减少 |
6.迷迭香酸具有抗氧化、延缓衰老、减肥降脂等功效,它的结构简式为
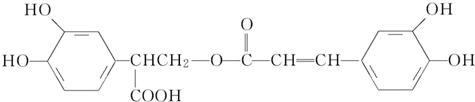 ,
,
以邻苯二酚为原料合成迷迭香酸的路线为
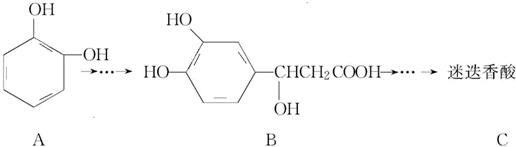
下列说法正确的是( )
 ,
,以邻苯二酚为原料合成迷迭香酸的路线为

下列说法正确的是( )
| A. | 有机物B可以发生取代、加成、消去、氧化反应 | |
| B. | 有机物A分子中所有原子一定在同一平面上 | |
| C. | 有机物C在浓硫酸催化下水解的一种产物是B | |
| D. | 1 mol B与足量的NaOH溶液反应,最多可消耗4 mol NaOH |
 某宝石的主要成分是Al2O3,其中混有少量Mg、Ti、Fe等杂质而使其呈蓝色.
某宝石的主要成分是Al2O3,其中混有少量Mg、Ti、Fe等杂质而使其呈蓝色.