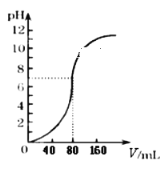
题目内容
【题目】某Al2O3样品中含有一定量的Cu、Fe、Fe2O3杂质。现通过下列生产过程,从该样品中提纯 Al2O3,并回收铁红。流程如下:
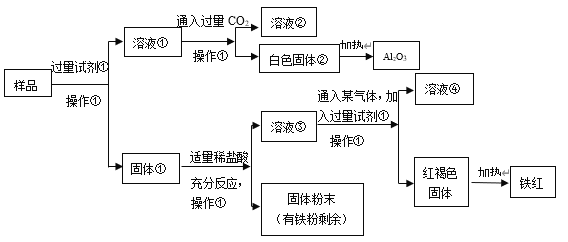
(1)操作①是________________,在实验室进行该操作需要的玻璃仪器有_____________________。
(2)试剂①是________________,该反应的离子方程式是__________________________________。
(3)固体①加入适量稀盐酸,可能发生的反应有:_________________________________(用离子方程式表达)。
(4)溶液③中铁元素的存在形式是___________________,如何用实验证明:_________________。
【答案】过滤 烧杯、漏斗、玻璃棒 NaOH溶液 Al2O3+2OH-=2AlO2-+H2O Fe2O3+6H+=2Fe3++3H2O、Fe+2H+=Fe2++H2↑、Fe+2Fe3+=3Fe2+ Fe2+ 取少量溶液,加入1滴KSCN溶液不显红色,再加入氯水,溶液变红,说明溶液中铁元素以Fe2+形式存在
【解析】
可以发现杂质均不和碱反应,因此过量试剂①是烧碱溶液,将氧化铝全部转化为![]() ,过滤后得到的溶液①即为偏铝酸钠溶液,偏铝酸钠溶液中通入过量
,过滤后得到的溶液①即为偏铝酸钠溶液,偏铝酸钠溶液中通入过量![]() 可以得到
可以得到![]() 白色固体和碳酸氢钠溶液,再加热使
白色固体和碳酸氢钠溶液,再加热使![]() 分解即可得到氧化铝;下面的固体①是铜、铁、氧化铁的混合物,加适量稀盐酸后过滤,得到溶液③,既然固体中有铁粉剩余,则证明铁过量,铁过量的情况下溶液中不可能存在
分解即可得到氧化铝;下面的固体①是铜、铁、氧化铁的混合物,加适量稀盐酸后过滤,得到溶液③,既然固体中有铁粉剩余,则证明铁过量,铁过量的情况下溶液中不可能存在![]() ,也就是说溶液③为
,也就是说溶液③为![]() 溶液,再加入过量的烧碱,得到氯化钠溶液和
溶液,再加入过量的烧碱,得到氯化钠溶液和![]() 红褐色固体,加热使
红褐色固体,加热使![]() 分解得到铁红,本题得解。
分解得到铁红,本题得解。
(1)操作①是过滤,过滤需要的玻璃仪器有烧杯、漏斗和玻璃棒;
(2)根据分析,试剂①是烧碱溶液,反应①是氧化铝溶于烧碱溶液:![]() ;
;
(3)根据分析,固体①的成分必定有铜、铁,可能会有氧化铁,因此加入盐酸后可能会发生![]() 、
、![]() 、
、![]() ;
;
(4)根据分析,溶液③中只有![]() ,若要证明
,若要证明![]() ,可以取少量溶液,加入1滴
,可以取少量溶液,加入1滴![]() 溶液不显红色,再加入氯水,若溶液变红,即可证明
溶液不显红色,再加入氯水,若溶液变红,即可证明![]() 的存在。
的存在。

【题目】依据下列实验现象,所得结论不正确的是
实验 | 实验现象 |
| ①品红溶液红色褪去,经检验溶液中含有SO42- ②加热褪色后的溶液至沸腾,未见颜色恢复,有气体溢出,可使蓝色石蕊试纸变红,遇淀粉碘化钾试纸,无明显变化。 |
A. 品红溶液褪色是氯水漂白所致
B. 集气瓶中发生了反应:Cl2 + SO2 + 2H2O H2SO4 + 2HCl
C. 依据现象②可确定产生的气体为SO2
D. 检验SO42-的试剂为:盐酸、BaCl2溶液
【题目】H2O2是实验室常见的强氧化剂,在医疗上可用作消毒剂等。
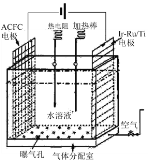
(1)一种正在开发的利用O2和H2O作原料通过化合制取H2O2的方法,其原理如图所示。该方法制取H2O2的总化学反应方程式为____。
(2)为探究外界条件对H2O2分解化学反应速率的影响,相关实验设计如下表所示:
试管 编号 | 实验目的 | H2O2溶液 | 温度 | 水的 体积/mL | FeCl3溶液体积/mL | |
质量 分数 | 体积/mL | |||||
Ⅰ | 为编号Ⅱ实验参照 | 12% | 5.0 | 常温 | 0 | 0 |
Ⅱ | 温度对反应速率的影响 | ( ) | 5.0 | 60℃ | 0 | 0 |
Ⅲ | 为编号Ⅳ实验参照 | 4.0% | 5.0 | 常温 | ( ) | 0 |
Ⅳ | ( ) | 4.0% | 5.0 | 常温 | 0 | 1.0 |
填写表中缺少的内容:Ⅱ_______;Ⅲ__________;Ⅳ_________。
(3)由铂(Pt位于左边)和金(Au位于右边)组成的纳米棒放入H2O2溶液中(如图),纳米棒将发生定向移动。
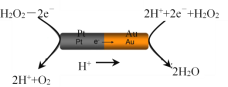
则:Au一侧为电池的____极(选填:“正”或“负”);纳米棒向____(选填:“左”或“右”)移动。