题目内容
【题目】H2O2是实验室常见的强氧化剂,在医疗上可用作消毒剂等。
(1)一种正在开发的利用O2和H2O作原料通过化合制取H2O2的方法,其原理如图所示。该方法制取H2O2的总化学反应方程式为____。
(2)为探究外界条件对H2O2分解化学反应速率的影响,相关实验设计如下表所示:
试管 编号 | 实验目的 | H2O2溶液 | 温度 | 水的 体积/mL | FeCl3溶液体积/mL | |
质量 分数 | 体积/mL | |||||
Ⅰ | 为编号Ⅱ实验参照 | 12% | 5.0 | 常温 | 0 | 0 |
Ⅱ | 温度对反应速率的影响 | ( ) | 5.0 | 60℃ | 0 | 0 |
Ⅲ | 为编号Ⅳ实验参照 | 4.0% | 5.0 | 常温 | ( ) | 0 |
Ⅳ | ( ) | 4.0% | 5.0 | 常温 | 0 | 1.0 |
填写表中缺少的内容:Ⅱ_______;Ⅲ__________;Ⅳ_________。
(3)由铂(Pt位于左边)和金(Au位于右边)组成的纳米棒放入H2O2溶液中(如图),纳米棒将发生定向移动。
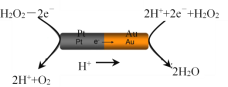
则:Au一侧为电池的____极(选填:“正”或“负”);纳米棒向____(选填:“左”或“右”)移动。
【答案】O2+2H2O ![]() 2H2O2 12% 1.0 催化剂对反应速率的影响 正 右
2H2O2 12% 1.0 催化剂对反应速率的影响 正 右
【解析】
(1)利用O2和H2O作原料通过化合制取H2O2,反应条件是电解(通电);
(2)根据单一变量控制法作答;
(3)由图2可知铂(Pt)和金(Au)组成的纳米棒与H2O2溶液形成原电池,H2O2中在铂极失电子发生氧化反应生成氧气和氢离子,结合原电池的工作原理作答。
(1)依据题意可知,利用 O2 和 H2O 作原料通过化合制取 H2O2的总的化学方程式为:O2+2H2O ![]() 2H2O2;
2H2O2;
(2)实验Ⅰ和实验Ⅱ的温度不同,要探究温度对反应速率的影响,其他条件要相同,则Ⅱ中双氧水的质量分数应与Ⅰ相同,为12%;实验Ⅲ没有使用催化剂,Ⅳ使用氯化铁作催化剂,可知这两个实验是探究催化剂对反应速率的影响,要求其他条件相同,控制溶液总体积相同就可使反应物浓度相同,则Ⅲ中应加蒸馏水1.0mL,
故答案为:12%;1.0;催化剂对反应速率的影响;
(3)由图2可知铂(Pt)和金(Au)组成的纳米棒与H2O2溶液形成原电池,H2O2中在铂极失电子发生氧化反应生成氧气和氢离子,氢离子移向正极(Au),氧气形成的气泡推动纳米棒将向右移动,
故答案为:正;右。

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案