题目内容
【题目】根据下图所示的转化关系,回答下列问题:
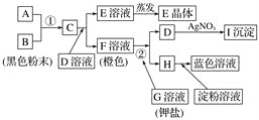
(1)写出反应①的离子方程式:______________________________________________;写出反应②的离子方程式:______________________。
(2)推出下列物质的化学式:E____________;I______________。
(3)在上述转化过程中,B、C、F、H的氧化能力由弱到强的顺序为______________________(写化学式)。
【答案】MnO2+2Cl-+4H+![]() Mn2++Cl2↑+2H2O Br2+2I-===2Br-+I2 KCl AgBr I2<Br2<Cl2<MnO2
Mn2++Cl2↑+2H2O Br2+2I-===2Br-+I2 KCl AgBr I2<Br2<Cl2<MnO2
【解析】
H中加入淀粉溶液变蓝,说明H为I2单质,F溶液为橙色,应为溴水,即F是Br2单质,其通过反应②即加入G(钾盐)溶液后有单质I2生成,说明G溶液一定是KI溶液,则D为KBr,因为C+KBr→Br2+E,很容易联想到卤素间的置换反应,比Br2单质氧化性强的应是Cl2,所以C应该是Cl2,B为黑色粉末,可想到A和B的反应是制Cl2的反应,则A为HCl,E为KCl,I为AgBr。
(1)反应①是实验室制氯气反应,离子方程式为:MnO2+2Cl-+4H+![]() Mn2++Cl2↑+2H2O,反应②是Br2与I-的置换反应,反应的方程式为:Br2+2I-===2Br-+I2,故答案为:MnO2+2Cl-+4H+
Mn2++Cl2↑+2H2O,反应②是Br2与I-的置换反应,反应的方程式为:Br2+2I-===2Br-+I2,故答案为:MnO2+2Cl-+4H+![]() Mn2++Cl2↑+2H2O;Br2+2I-===2Br-+I2
Mn2++Cl2↑+2H2O;Br2+2I-===2Br-+I2
(2)C为Cl2,Cl2与KBr反应生成Br2和KCl,所以E为KCl,D为KBr与AgNO3反应生成AgBr沉淀,所以I为AgBr,故答案为:KCl;AgBr。
(3)B、C、F、H分别为:MnO2、Cl2、Br2、I2,根据氧化剂的氧化性大于氧化产物的氧化性,可以推出氧化能力由弱到强的顺序为I2<Br2<Cl2<MnO2,故答案为:I2<Br2<Cl2<MnO2

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案