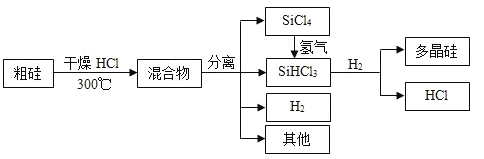
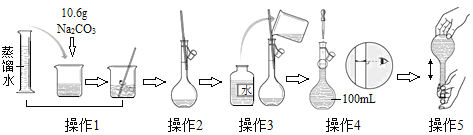
题目内容
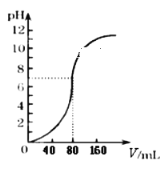
【题目】用1.0mol·L -1NaOH溶液中和某浓度硫酸溶液时,其pH和所加NaOH溶液的体积(V)关系如右图所示,则原硫酸溶液的物质的量浓度和恰好完全反应后溶液的总体积分别是(设二者混合后体积为二者体积之和)
A. 0.5mol·L-1 80mLB. 0.5mol·L-1 160mL
C. 1.0mol·L-1 80mLD. 1.0mol·L-1 160mL
【答案】B
【解析】
根据硫酸溶液的pH确定氢离子浓度,再根据硫酸和氢离子之间的关系式确定硫酸浓度;根据硫酸和氢氧化钠反应的关系式计算硫酸溶液的体积,硫酸和氢氧化钠溶液体积就是完全反应后溶液的总体积。
根据图象知,硫酸的pH=0,则c(H+)=1mol/L,c(H2SO4)=1/2c(H+)=0.5mol/L,完全反应时氢氧化钠溶液的体积为80mL,根据反应中氢氧化钠和硫酸的关系式得:n(NaOH)=2n(H2SO4),设硫酸溶液的体积为VL,所以2×0.5mol/L×VL=1mol/L×0.08L,所以V(H2SO4)=80mL,则混合溶液体积=80mL+80mL=160mL,故B正确;
故答案选B。

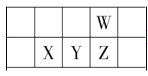
【题目】有X、Y、Z、M、R五种短周期主族元素,部分信息如下表所示:
X | Y | Z | M | R | |
原子半径/nm | 0.074 | 0.099 | |||
主要化合价 | +4,-4 | -2 | -1,+7 | ||
其它 | 阳离子核外无电子 | 无机非金属材料的主角 | 第三周期简单离子半径最小 |
请回答下列问题:
(1)Z与NaOH溶液反应的离子方程式:___。(用元素符号表示,下同。)
(2)下列事实能说明R非金属性比Y强这一结论的是___(选填字母序号)。
a.常温下Y的单质呈固态,R的单质呈气态
b.气态氢化物稳定性R>Y
c.Y与R形成的化合物中Y呈正价
d.Y与R各自形成的含氧酸中R的氧化性更强
(3)经测定X2M2为二元弱酸,写出X2M2的电子式___。其酸性比碳酸的还要弱,请写出其第一步电离的电离方程式___。
(4)已知I2能做X2M2分解的催化剂:
第一步:X2M2+I2=2XIM;
第二步:……
请写出第二步反应的化学方程式___。
(5)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现在改用X2M2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式___。
【题目】某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质。请填写下列空白:
Ⅰ.测定过氧化氢的含量
(1)移取10.00 mL密度为ρ g/mL的过氧化氢溶液至250 mL_______(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00 mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式为________。
(3)判断滴定到达终点的现象是_________________________。
(4)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为____________。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_________(填“偏高”或“偏低”或“不变”)。
Ⅱ.探究过氧化氢的性质
该化学兴趣小组根据所提供的实验条件设计了两个实验,分别证明了过氧化氢的氧化性和不稳定性。(实验条件:试剂只有过氧化氢溶液、氯水、碘化钾淀粉溶液、饱和硫化氢溶液,实验仪器及用品可自选。)
请将他们的实验方法和实验现象填入下表:
实验内容 | 实验方法 | 实验现象 |
验证氧化性 | ____________ | ____________ |
验证不稳定性 | ____________ | ____________ |