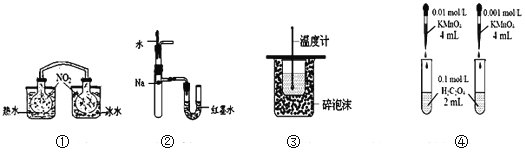
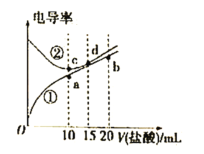
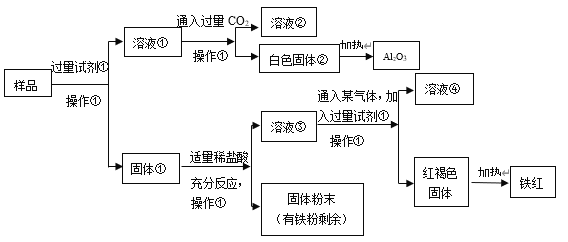
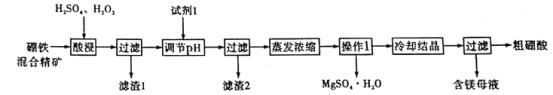
题目内容
【题目】某温度下,向c(H+)=1×10-6mol·L-1的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液中c(H+)=1×10-3mol·L-1。下列对该溶液的叙述不正确的是( )
A.该温度高于25℃
B.![]() 的电离方程式为NaHSO4=Na++H++SO42-
的电离方程式为NaHSO4=Na++H++SO42-
C.加入NaHSO4晶体抑制了水的电离
D.由水电离出来的H+的浓度为1×10-12mol·L-1
【答案】D
【解析】
A. 升高温度促进水的电离,因25℃时水电离的氢离子浓度c(H+)=1×10-7 mol·L-1,该温度下水电离的氢离子浓度c(H+)=1×10-6 mol·L-1,说明促进了水的电离,故该温度高于25℃,A项正确;
B. ![]() 为强电解质,在水中可电离出钠离子、氢离子和硫酸根离子,其电离方程式为NaHSO4=Na++H++SO42—,B项正确;
为强电解质,在水中可电离出钠离子、氢离子和硫酸根离子,其电离方程式为NaHSO4=Na++H++SO42—,B项正确;
C. 加入NaHSO4晶体,在水中电离出钠离子、氢离子和硫酸根离子,相当于一元强酸,氢离子浓度增大,抑制水的电离,C项正确;
D. 某温度下,蒸馏水中c(H+)=1×10-6 mol·L-1,则水的离子积常数Kw=1×10-12,加入NaHSO4晶体形成强酸溶液,则氢氧根离子来自于水的电离,溶液中的氢离子浓度c(H+)=1×10-3mol·L-1,故氢氧根离子浓度=![]() mol/L=10-9mol/L,又该溶液中水电离出的氢离子浓度等于水电离的氢氧根离子浓度,则由水电离出来的H+的浓度为10-9mol/L,D项错误;
mol/L=10-9mol/L,又该溶液中水电离出的氢离子浓度等于水电离的氢氧根离子浓度,则由水电离出来的H+的浓度为10-9mol/L,D项错误;
答案选D。

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目