题目内容
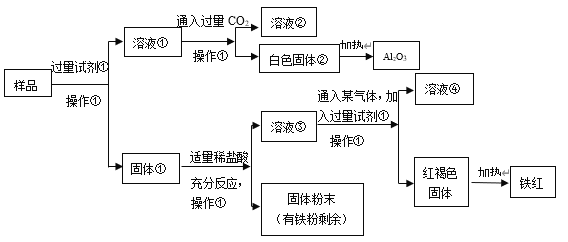
【题目】“以废治废”是基于“绿色化学”观念治理污染的思路。用工业废碱渣(主要成分为Na2CO3)吸收烟气中的SO2,得到亚硫酸钠(Na2SO3)粗品。其流程如下,下列说法正确的是
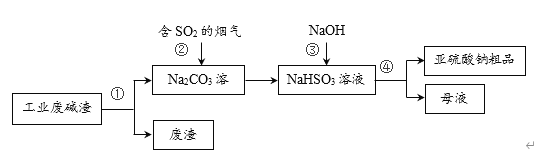
A.操作①、④均为过滤
B.步骤②中发生了置换反应
C.步骤③发生的反应为:NaHSO3+NaOH = Na2SO3+H2O
D.亚硫酸钠粗品中不可能含有Na2SO4
【答案】C
【解析】
将工业废碱渣溶于水,过滤可得碳酸钠溶液和废渣,将含有SO2的烟气通入碳酸钠溶液中,形成了亚硫酸氢钠溶液,加入烧碱中和后得到亚硫酸钠溶液,隔绝空气加热浓缩、降温结晶、过滤可得亚硫酸钠粗品,据此分析判断。
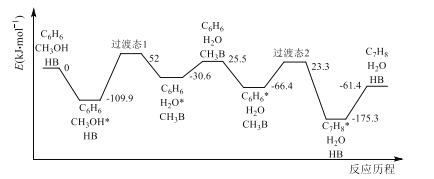
A. 操作①为溶解、过滤,④均为隔绝空气加热浓缩、降温结晶、过滤,A项错误;
B. 步骤②中发生的反应为:Na2SO3+SO2+H2O=2NaHSO3,,属于化合反应,不是置换反应,B项错误;
C. 步骤③是亚硫酸钠与氢氧化钠的反应,发生的反应为:NaHSO3+NaOH=Na2SO3+H2O,C项正确;
D. 亚硫酸钠中S为+4价,易被空气中的氧气氧化为+6价,即生成了Na2SO4,因此亚硫酸钠粗品中可能含有Na2SO4,D项错误。
答案选C。

【题目】硫酸是极其重要的化工原料,在工业、农业、医药、军事等领域应用广泛。工业上通常用接触法制硫酸,主要原料是硫铁矿和空气。接触法制硫酸的生产过程大致可分为三个阶段:二氧化硫的制取和净化;二氧化硫转化为三氧化硫;三氧化硫的吸收和硫酸的生成。为了防止环境污染并对尾气进行综合利用,硫酸厂常用氨水吸收尾气的SO2、SO3等气体,再向吸收液中加入浓硫酸,以制取高浓度的SO2及(NH4)2SO4和NH4HSO4固体。为了测定上述(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液50.00mL,加热至120℃左右,使氨气全部逸出[(NH4)2SO4和NH4HSO4的分解温度均高于200℃],测得有关实验数据如下(标准状况):
实验 | 样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L(标准状况) |
1 | 7.24 | 50.00 | 1.792 |
2 | 14.48 | 50.00 | 3.584 |
3 | 21.72 | 50.00 | 4.032 |
4 | 36.20 | 50.00 | 2.240 |
(1)由1组数据直接推测:1.81g样品进行同样实验时,生成氨气的体积(标准状况)为___L。
(2)试计算该混合物中(NH4)2SO4和 NH4HSO4的物质的量之比为___。
(3)求所用NaOH溶液的物质的量浓度___mol/L。