题目内容
2.氧和硫的化合物在化工生产上应用非常广泛.试回答下列问题: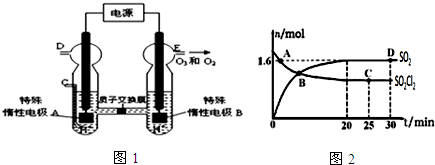
(1)O3可通过电解稀硫酸(原理如图1所示,该条件下3O2=2O3可以发生)制得.图中阳极为B(填A或B).若C处通入O2,则A极的电极反应式为:O2+4H++4e-=2H2O,若C处不通入O2,D、E处分别收集到1mol和0.4mol气体,则E处收集的气体中O3所占的体积分数为50%(忽略 O3的分解).
(2)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应.己知:
6Ag(s)+O3(g)═3Ag2O(s);△H=-235kJ/mol;
2Ag2O(s)═4Ag(s)+O2(g);△H=+60kJ/mol;
则反应 2O3(g)=3O2(g)的△H=-290kJ/mol.
(3)SO2Cl2常用于制造医药品、染料、表面活性剂等.已知:SO2Cl2(g)?SO2(g)+Cl2(g)△H=+98kJ•mol-1.某温度时向体积为2L的恒容密闭容器中充入0.20mol SO2Cl2,达到平衡时,容器中含0.1mol SO2,该温度时反应的平衡常数为0.05mol/L(请带单位).将上述所得混合气体溶于足量BaCl2溶液中,最终生成沉淀的质量为46.6g.
(4)对(3)中的反应,在400℃,1.01×105Pa条件下,向容积为2L的恒容密闭容器中充入一定量的SO2Cl2,n(SO2)和n(SO2Cl2)随时间的变化曲线如图2所示.
①0~20min反应的平均速率υ(SO2Cl2)=0.04mol/(L.min).
②下列叙述正确的是AD
A.A点υ正(SO2Cl2)>υ逆(SO2Cl2)
B.密度和平均摩尔质量不变均说明处于平衡状态
C.其它条件不变,若增大压强,n(SO2)比图中D点的值大
D.其它条件不变,500℃时反应达平衡,n(SO2)比图中D点的值大.
分析 (1)由图可知,B极生成O2、O3,B极反应氧化反应,电解池阳极发生氧化反应;
C处通入O2,O2发生还原反应,在酸性条件下生成水;
若C处不通入O2,实质为电解水,D处为氢气,物质的量为0.5mol,E处为氧气、臭氧,物质的量共为0.2mol,令臭氧的物质的量为xmol,利用电子转移守恒列放出计算x的值,再根据体积分数定义计算;
(2)Ⅰ、6Ag(s)+O3(g)═3Ag2O(s),△H=-235kJ•mol-1,
Ⅱ、2Ag2O(s)═4Ag(s)+O2(g),△H=+60kJ•mol-1,
根据盖斯定律可知Ⅰ×2+Ⅱ×3可得到,2O3(g)═3O2(g),以此计算反应热;
(3)根据二氧化硫和反应热之间的关系式计算放出的热量;化学平衡常数K=$\frac{c(Cl{\;}_{2}).c(SO{\;}_{2})}{c(SO{\;}_{2}Cl{\;}_{2})}$;根据硫原子守恒计算生成硫酸钡的质量;
(4)①先计算二氧化硫的反应速率,再根据同一可逆反应、同一时间段内各物质的反应速率之比等于其计量数之比计算υ(SO2Cl2);
②A.A点平衡向正反应方向移动,正反应速率大于逆反应速率;
B.因为反应前后质量不变,又体积不变,所以密度一直不变;
C.增大压强,平衡向体积减小的方向移动即逆反应方向,据此分析;
D.其它条件不变,升高温度平衡向正反应方向移动,则平衡时n(SO2)增大,据此分析;
解答 解:(1)由图可知,B极生成O2、O3,B极反应氧化反应,电解池阳极发生氧化反应,故B为阳极;C处通入O2,O2发生还原反应,在酸性条件下生成水,电极反应式为O2+4H++4e-=2H2O;若C处不通入O2,实质为电解水,D处为氢气,物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,E处为氧气、臭氧,物质的量共为$\frac{4.48L}{22.4L/mol}$=0.2mol,令臭氧的物质的量为xmol,根据电子转移守恒有0.5mol×2=xmol×3×2+(0.2mol-xmol)×2×2,解得x=0.1,所以E处收集的气体中O3所占的体积分数为$\frac{0.1mol}{0.2mol}$×100%=50%;故答案为:B;O2+4H++4e-=2H2O;50%.
(2)Ⅰ、6Ag(s)+O3(g)═3Ag2O(s),△H=-235kJ•mol-1,
Ⅱ、2Ag2O(s)═4Ag(s)+O2(g),△H=+60kJ•mol-1,
根据盖斯定律可知Ⅰ×2+Ⅱ×3可得到,2O3(g)═3O2(g),则反应热△H=(-235kJ•mol-1)×2+(+60kJ•mol-1)×3=-290kJ/mol,
故答案为:-290kJ/mol;
(3)c(SO2)=c(Cl2)=$\frac{0.1mol}{2L}$=0.05mol/L、c(SO2Cl2)=$\frac{0.2mol-0.1mol}{2L}$=0.05mol/L、
化学平衡常数K=$\frac{c(Cl{\;}_{2}).c(SO{\;}_{2})}{c(SO{\;}_{2}Cl{\;}_{2})}$=$\frac{0.05mol/L×0.05mol/L}{0.05mol/L}$=0.05mol/L;
根据硫原子守恒计算生成硫酸钡的质量,则m(BaSO4)=n(BaSO4)M(BaSO4)=n(SO2)M(BaSO4)=0.2mol×233g/mol=46.6g,
故答案为:0.05 mol/L;46.6g;
(4)①υ(SO2)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{1.6mol}{2L}}{20min}$=0.04mol/(L.min),同一可逆反应中同一时间段内,各物质的反应速率之比等于其计量数之比,所以υ(SO2Cl2)=υ(SO2)=0.04mol/(L.min),故答案为:0.04mol/(L.min);
②A.A点平衡向正反应方向移动,说明正反应速率大于逆反应速率,即A点υ正(SO2Cl2)>υ逆(SO2Cl2),故正确;
B.因为反应前后质量不变,又体积不变,所以密度一直不变,则密度不变不能说明处于平衡状态,故错误;
C.增大压强,平衡向体积减小的方向移动即逆反应方向,所以n(SO2)减小,比图中D点的值小,故错误;
D.其它条件不变,升高温度平衡向正反应方向移动,则平衡时n(SO2)增大,所以n(SO2)比图中D点的值大,故正确;
故选:AD.
点评 本题考查了电解原理的应用、盖斯定律的应用以及化学平衡的有关知识,根据平衡状态判断的依据、反应速率公式、平衡常数公式等知识点来分析解答,易错选项是(3)中硫酸钡质量的计算,很多同学往往只根据二氧化硫的量计算硫酸钡而导致错误,为易错点.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| 序号 | ① | ② | ③ | ④ |
| 溶液 | 氨水 | NaOH | CH3COOH | HCl |
| 浓度c/mol•L-1 | 0.01 | 0.01 | 0.01 | 0.01 |
| A. | 由水电离出的c(H+):①=②=③=④ | |
| B. | 溶液的pH:②>①>④>③ | |
| C. | ②、③混合呈中性,所需溶液的体积:③>② | |
| D. | ①、④等体积混合,所得溶液中离子的浓度:c(NH4+)=c(Cl-)>c(H+)=c(OH-) |
| 选项 | 事实 | 解释 |
| A | 用热的纯碱溶液洗去油污 | Na2CO3可作为油脂分解的催化剂 |
| B | 铝罐车可用于运输稀硝酸 | 铝表面形成致密氧化膜具有保护作用 |
| C | 甘油作为化妆品中的保湿剂 | 甘油易与水形成氢键 |
| D | 氢氟酸刻蚀水晶工艺品 | HF具有强酸性 |
| A. | A | B. | B | C. | C | D. | D |
| A. | SO3、NO3-、BF3都是平面三角型 | B. | P4、CS2、PH3都是非极性分子 | ||
| C. | 金刚石、石墨、SiC都是原子晶体 | D. | 第一电离能:N>O>C |
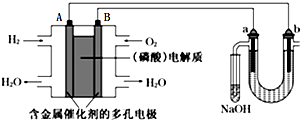
| A. | 电池工作时,B极反应式为O2+2H2O+4e-=4OH- | |
| B. | 电解时,电子流动路径是:A极→外电路→b极→溶液→a极→B极 | |
| C. | NaOH溶液充分吸收后所得溶液可制作漂白水 | |
| D. | 当电池中消耗2.24L(标准状况)H2时,a极周围也会产生2.24L(标准状况)气体 |
| A. | 利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用 | |
| B. | 日常生活中人们大量使用铝制品,是因为常温下铝不能与氧气反应 | |
| C. | 煤炭经气化、液化和干馏等过程,可获得清洁能源和重要的化工原料 | |
| D. | 神舟10号飞船所用太阳能电池板可将光能转换为电能,所用转换材料是单晶硅 |
| 元素 | N | S | O | Si |
| 原子半径/10-10m | 0.75 | 1.02 | 0.74 | 1.17 |
| A. | 0.80×10-10m | B. | 1.20×10-10m | C. | 1.10×10-10m | D. | 0.70×10-10m |
 .
.