题目内容
12.室温下,关于下列四种溶液的叙述中,正确的是( )| 序号 | ① | ② | ③ | ④ |
| 溶液 | 氨水 | NaOH | CH3COOH | HCl |
| 浓度c/mol•L-1 | 0.01 | 0.01 | 0.01 | 0.01 |
| A. | 由水电离出的c(H+):①=②=③=④ | |
| B. | 溶液的pH:②>①>④>③ | |
| C. | ②、③混合呈中性,所需溶液的体积:③>② | |
| D. | ①、④等体积混合,所得溶液中离子的浓度:c(NH4+)=c(Cl-)>c(H+)=c(OH-) |
分析 A.酸或碱抑制水电离,含有弱根离子的盐促进水电离,酸的酸性越强,其抑制水电离程度越大,据此分析解答;
B.PH=-lgc(H+),根据溶液的酸碱性确定溶液中pH大小;
C.乙酸钠是强碱弱酸盐水解呈碱性,②、③等体积混合呈碱性,要使乙酸和氢氧化钠的混合溶液呈中性,则需乙酸的物质的量稍微大些;
D.①、④等体积混合生成的氯化铵是强酸弱碱盐,水解呈酸性.
解答 解:A.等浓度的这四种溶液都抑制水电离,氢氧化钠中氢氧根离子浓度和盐酸中氢离子浓度相等,所以二者抑制水电离程度相等,醋酸中氢离子浓度小于盐酸,所以醋酸抑制水电离程度小于盐酸,氨水中氢氧根离子浓度小于氢氧化钠,所以氨水抑制水电离程度小于氢氧化钠,氨水和醋酸电离程度相当,所以抑制水电离程度相等,所以由水电离出的C(H+)大小关系正确的是①=③>②=④,故A错误;
B.PH=-lgc(H+),弱电解质在水溶液里存在电离平衡,强电解质在水溶液里完全电离,所以物质的量浓度相等的盐酸和醋酸,醋酸的pH大于盐酸,物质的量浓度相等的氨水和氢氧化钠,氢氧化钠的pH大于氨水,溶液的pH:②>①>③>④,故B错误;
C.乙酸钠是强碱弱酸盐,水解呈碱性,要使乙酸和氢氧化钠的混合溶液呈中性,则需乙酸的物质的量稍微大些,因乙酸浓度等于氢氧化钠,所以所需溶液的体积:③>②,溶质为乙酸、乙酸钠,故C正确;
D.①、④等体积混合,得到氯化铵溶液,溶液中,铵根离子部分水解,则氯离子浓度最大,水解显酸性,则c(H+)>c(OH-),且显性离子大于隐性离子,则溶液中离子浓度为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),故D错误;
故选C.
点评 本题考查了弱电解质的电离、pH值相对大小的比较等知识点,注意水溶液中酸或碱都抑制水的电离,溶液中氢离子或氢氧根离子浓度越大,水的电离程度越小,掌握演的水解和弱电解质的电离平衡时解答关键,题目难度中等.

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案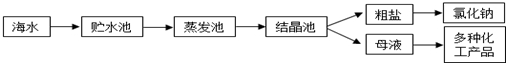
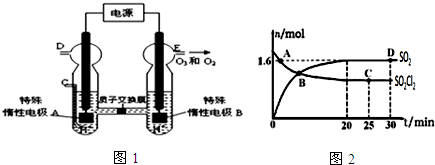
(1)①粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用试剂为:A:盐酸;B:BaCl2溶液;C:NaOH溶液;D:Na2CO3溶液.加入试剂的顺序是CBDA或BCDA.
②电解饱和食盐水时,与电源正极相连的电极上发生的反应为2Cl--2e-=Cl2↑,与电源负极相连的电极附近溶液pH的变化是变大.
(2)工业上从海水中提取的NaCl,可用来制取纯碱,其简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱,则气体B是CO2(填化学式),由NaCl制取纯碱反应的化学方程为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl、2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
(3)海水提镁的一段工艺流程如图:
浓海水的主要成分如下:
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
 为了探索外界条件对反应2NO2(g)?N2O4(g)△H=-57kJ•mol-1的影响,若保持气体总质量不变,在温度为T1、T2时,通过实验得到平衡体系中NO2的体积分数随压强变化曲线,实验结果如图所示.下列说法正确的是( )
为了探索外界条件对反应2NO2(g)?N2O4(g)△H=-57kJ•mol-1的影响,若保持气体总质量不变,在温度为T1、T2时,通过实验得到平衡体系中NO2的体积分数随压强变化曲线,实验结果如图所示.下列说法正确的是( )| A. | a、c两点气体的平均相对分子质量:a>c | |
| B. | a、c两点气体的颜色:a浅,c深 | |
| C. | b、c两点的平衡常数:Kb=Kc | |
| D. | 状态a通过升高温度可变成状态b |
| A. | c(CH3COO-)+c(NO3-)+c(OH-)=c(H+)+c(Na+) | |
| B. | c(CH3COO-)=c(Na+)=c(NO3-)>c(CH3COOH)>c(H+)>c(Na+) | |
| C. | c(CH3COO-)>c(NO3-)>c(CH3COOH)=c(Na+)>c(H+)>c(OH-) | |
| D. | c(Na+)>c(NO3-)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |

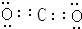 ,Z与氢元素形成的化合物溶于水后,溶液的pH>7(填“<”、“>”或“=”).
,Z与氢元素形成的化合物溶于水后,溶液的pH>7(填“<”、“>”或“=”).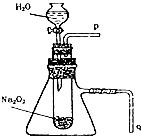 用脱脂棉花包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来.
用脱脂棉花包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来. ).
).
 .
. .
. .
. 、
、 、
、 .
.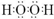 .
.