题目内容
11.常温下,下列各组离子在指定溶液中能大量共存的是( )| A. | pH=1的溶液中:Mg2+、Na+、AlO2-、SO42- | |
| B. | 无色透明的水溶液中:K+、Mg2+、I-、Cl- | |
| C. | 含有大量NO3-的溶液中:H+、Na+、Fe2+、Cl- | |
| D. | 含有大量Al3+的溶液中:Ca2+、K+、Cl-、HCO3- |
分析 A.pH=1的溶液呈强酸性,离子之间不反应的能大量共存;
B.无色溶液不含有色离子,离子之间不反应的能大量共存;
C.酸性条件下,硝酸根离子具有强氧化性;
D.含有大量铝离子的溶液呈酸性.
解答 解:A.pH=1的溶液呈强酸性,离子之间不反应的能大量共存,AlO2-和氢离子反应而不能大量共存,故A错误;
B.无色溶液不含有色离子,离子之间不反应的能大量共存,这几种离子无色且离子之间不反应,所以能大量共存,故B正确;
C.酸性条件下,硝酸根离子具有强氧化性,能氧化亚铁离子生成铁离子而不能大量共存,故C错误;
D.含有大量铝离子的溶液呈弱酸性,铝离子和碳酸氢根离子之间发生双水解反应而不能大量共存,故D错误;
故选B.
点评 本题考查离子共存,为高频考点,明确离子性质及离子共存条件是解本题关键,涉及复分解反应、双水解反应和氧化还原反应,易错选项是C.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
1.铜的冶炼过程大致可分为:
①富集,将硫化物矿进行浮选;
②焙烧,主要反应为2CuFeS2+4O2═Cu2S+3SO2+2FeO(炉渣);
③制粗铜,在1200℃发生的主要反应为2Cu2S+3O2═2Cu2O+2SO2;2Cu2O+Cu2S═6Cu+SO2↑;
④电解精炼铜.
下列说法正确的是( )
①富集,将硫化物矿进行浮选;
②焙烧,主要反应为2CuFeS2+4O2═Cu2S+3SO2+2FeO(炉渣);
③制粗铜,在1200℃发生的主要反应为2Cu2S+3O2═2Cu2O+2SO2;2Cu2O+Cu2S═6Cu+SO2↑;
④电解精炼铜.
下列说法正确的是( )
| A. | 冶炼过程中的尾气可用来制硫酸 | |
| B. | 上述过程中,由1molCuFeS2制取1molCu时共消耗2molO2 | |
| C. | 在反应2Cu2O+Cu2S═6Cu+SO2↑中,只有Cu2O作氧化剂 | |
| D. | 电解精炼铜的过程中,每转移1mol电子时,阳极溶解铜的质量为32g |
19.氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于区域3的是( ) 

| A. | 4Fe(0H)2+O2+2H2O═4Fe(OH)3 | B. | 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ | ||
| C. | 4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O | D. | 2CuO+C$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑ |
16.NA为阿伏伽德罗常数的值.下列叙述正确的是( )
| A. | 1.0L 1.0mo1•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 常温常压下,8gO2含有4NA个电子 | |
| C. | 25℃时pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| D. | 1mol的羟基与1mol的氢氧根离子所含电子数均为9NA |
3.在一定条件下,某化合物W受热分解:2W$\frac{\underline{\;△\;}}{\;}$A↑+2B↑+4C↑,测得反应后生成的混合气体是相同条件下等体积H2质量的11.43倍,则W的摩尔质量是( )
| A. | 11.43 | B. | 22.86g/mol | C. | 80.01 | D. | 80.01g/mol |
20.已知1mol氢气完全燃烧生成水蒸气时放出热量242kJ,且氧气中1mol O=O键完全断裂时吸收热量496kJ,水蒸气中1mol H-O键形成时放出热量463kJ,则氢气中1mol H-H键断裂时吸收热量为( )
| A. | 920 kJ | B. | 557 kJ | C. | 436 kJ | D. | 188 kJ |
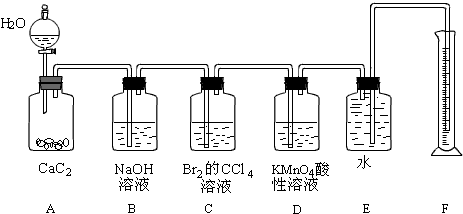
 ;为了得到较为平稳的乙炔气流,装置A的分液漏斗中常用饱和食盐水来代替水.
;为了得到较为平稳的乙炔气流,装置A的分液漏斗中常用饱和食盐水来代替水.