题目内容
20.已知1mol氢气完全燃烧生成水蒸气时放出热量242kJ,且氧气中1mol O=O键完全断裂时吸收热量496kJ,水蒸气中1mol H-O键形成时放出热量463kJ,则氢气中1mol H-H键断裂时吸收热量为( )| A. | 920 kJ | B. | 557 kJ | C. | 436 kJ | D. | 188 kJ |
分析 根据化学反应放出的热量=新键生成释放的能量-旧键断裂吸收的能量,结合反应方程式进行计算.
解答 解:氢气完全燃烧生成水蒸气是放热反应,所以化学反应放出的热量=新键生成释放的能量-旧键断裂吸收的能量,设氢气中1molH-H键断裂时吸收热量为Q,根据方程式:H2+$\frac{1}{2}$O2$\frac{\underline{\;点燃\;}}{\;}$H2O,则242kJ=2×463kJ-(Q+$\frac{1}{2}$×496kJ),解得Q=436KJ,
故选C.
点评 本题考查反应热的相关计算,难度不大,计算的方法是解题的关键.

练习册系列答案
相关题目
11.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | pH=1的溶液中:Mg2+、Na+、AlO2-、SO42- | |
| B. | 无色透明的水溶液中:K+、Mg2+、I-、Cl- | |
| C. | 含有大量NO3-的溶液中:H+、Na+、Fe2+、Cl- | |
| D. | 含有大量Al3+的溶液中:Ca2+、K+、Cl-、HCO3- |
8.下列除杂方法正确的是( )
①除去乙烷中少量的乙烯:通入H2,加催化剂反应
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液
③除去NaBr溶液中的NaI:用氯水氧化NaI,再用CCl4萃取分液
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏
⑤只含有泥沙的粗盐:可通过溶解、过滤、蒸发、结晶的方法提纯.
①除去乙烷中少量的乙烯:通入H2,加催化剂反应
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液
③除去NaBr溶液中的NaI:用氯水氧化NaI,再用CCl4萃取分液
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏
⑤只含有泥沙的粗盐:可通过溶解、过滤、蒸发、结晶的方法提纯.
| A. | ①②③ | B. | ②④⑤ | C. | ③④⑤ | D. | ②③④ |
15.下列说法或表示法正确的是( )
| A. | 等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 由C(石墨)═C(金刚石)△H>0,可知金刚石比石墨稳定 | |
| C. | 在稀溶液 中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ | |
| D. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 |
5.下列说法正确的是( )
| A. | Cu与石墨都能导电,但都属于非电解质 | |
| B. | AgCl与BaSO4都是难溶性盐,但都属于强电解质 | |
| C. | SO2与CaO都是氧化物,因此SO2、CaO都是非电解质 | |
| D. | NaCl与HCl都是电解质,因此熔融NaCl、液态HCl都能导电 |
12.下列装置所示的实验中,能达到实验目的是( )
| A. |  分离碘和酒精 | B. | 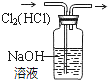 除去CL2中HCL | C. | 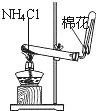 实验室制氨气 | D. | 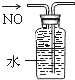 排水法收集NO |

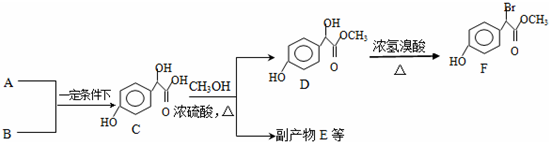
 .
. 中①、②、③(从左到右编号)3个-OH的酸性由强到弱的顺序是:③>①>②.
中①、②、③(从左到右编号)3个-OH的酸性由强到弱的顺序是:③>①>②. .
.