题目内容
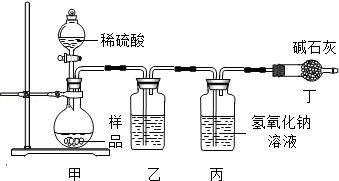
2.实验室用如图装置来制备电石气,并验证电石气的某些化学性质,制备的电石气气体中往往含有少量的H2S气体,请按下列要求填空: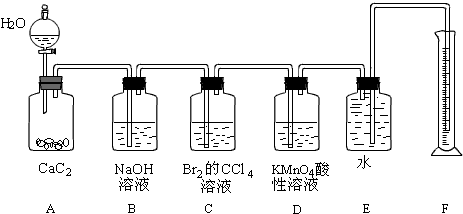
(1)实验室制乙炔反应的化学方程式是CaC2+2H2O→CH≡CH↑+Ca(OH)2;产物电石气的电子式:
 ;为了得到较为平稳的乙炔气流,装置A的分液漏斗中常用饱和食盐水来代替水.
;为了得到较为平稳的乙炔气流,装置A的分液漏斗中常用饱和食盐水来代替水.(2)装置B中盛放有足量的NaOH溶液的作用是除去H2S杂质,以防干扰后续实验,反应的离子方程式是2OH-+H2S=2H2O+S2-
(3)装置C中观察到的现象是溶液褪色,反应的方程式是2Br2+CH≡CH→CHBr2-CHBr2,该反应的类型是加成反应.
(4)装置D中观察到的现象是紫色褪去.
分析 实验室用电石和水反应制备乙炔,其中含有杂质,为了净化和检验乙炔气体,测定气体体积,则需要的装备依次为:气体制备装置、净化装置(除硫化氢)、检验装置、性质实验装置、排水测体积的装置,
(1)实验室制备乙炔是利用电石和水反应生成乙炔和氢氧化钙,碳化钙与水反应很剧烈,用饱和食盐水可以减缓反应;
(2)制备的乙炔气体中往往含有少量的H2S气体,通过NaOH溶液除去硫化氢,防止乙炔的检验;
(3)除去硫化氢的乙炔气体通过溴的四氯化碳溶液,会发生加成反应;
(4)乙炔通过高锰酸钾溶液会被氧化生成二氧化碳,溶液褪色.
解答 解:(1)实验室制备乙炔是利用电石和水反应生成乙炔和氢氧化钙,反应的化学方程式为:CaC2+2H2O→CH≡CH↑+Ca(OH)2,乙炔的电子式为 ,碳化钙与水反应很剧烈,用饱和食盐水可以减缓反应,所以为了得到平稳的气流,用饱和食盐水代替水,
,碳化钙与水反应很剧烈,用饱和食盐水可以减缓反应,所以为了得到平稳的气流,用饱和食盐水代替水,
故答案为:CaC2+2H2O→CH≡CH↑+Ca(OH)2; ;饱和食盐水;
;饱和食盐水;
(2)硫化氢气体具有还原性,也会导致溴水、高锰酸钾溶液褪色,装置B中NaOH溶液的作用是除去乙炔中的硫化氢,2OH-+H2S=2H2O+S2-,防止干扰后续检验实验;
故答案为:除去H2S杂质,以防干扰后续实验;2OH-+H2S=2H2O+S2-;
(3)乙炔气体通过溴的四氯化碳溶液,会发生加成反应,装置C中观察到的现象是溶液褪色,反应的化学方程式为:2Br2+CH≡CH-→CHBr2-CHBr2,发生的反应类型为加成反应;
故答案为:溶液褪色,2Br2+CH≡CH→CHBr2-CHBr2;加成反应;
(4)乙炔通过高锰酸钾溶液,乙炔含有不饱和键,被高锰酸钾溶液氧化生成二氧化碳,装置D中观察到的现象是溶液褪色,发生的反应为氧化反应;
故答案为:紫色褪去.
点评 本题考查了物质性质的探究实验分析判断,实验数据的分析和计算,乙炔性质和制备,掌握实验基本操作和实验设计方法是解题关键,题目难度中等.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案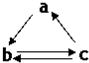 下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )| a | b | c | |
| A | Al | AlCl3 | Al(OH)3 |
| B | HNO3 | NO | NO2 |
| C | Si | SiO2 | H2SiO3 |
| D | SO3 | H2SO4 | S |
| A. | A | B. | B | C. | C | D. | D |
| A. | Cu---Cu(OH)2 | B. | H2O2--O2 | C. | CaCO3---CaCl2 | D. | K2CO3--KCl |
| A. | 18.4mol/L 34.7% | B. | 20.4mol/L 38.5% | ||
| C. | 18.4mol/L 38.5% | D. | 20.4mol/L 34.7% |
| A. | pH=1的溶液中:Mg2+、Na+、AlO2-、SO42- | |
| B. | 无色透明的水溶液中:K+、Mg2+、I-、Cl- | |
| C. | 含有大量NO3-的溶液中:H+、Na+、Fe2+、Cl- | |
| D. | 含有大量Al3+的溶液中:Ca2+、K+、Cl-、HCO3- |
| A. |  分离碘和酒精 | B. | 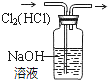 除去CL2中HCL | C. | 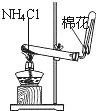 实验室制氨气 | D. | 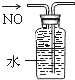 排水法收集NO |