题目内容
1.同温同压下,将1体积的CO2和2体积的CO进行比较,则CO2与CO的:(1)分子数之比为1:2;
(2)原子数之比为3:4;
(3)质量之比为11:14
(4)物质的量之比为1:2.
(5)密度之比为11:7
(6)摩尔质量之比为11:7.
分析 (1)同温同压下,气体分子数目之比等于体积之比;
(2)同温同压下,气体体积之比等于物质的量之比,结合分子含有原子数目计算;
(3)同温同压下,气体体积之比等于物质的量之比,再根据m=nM计算;
(4)同温同压下,气体体积之比等于物质的量之比;
(5)同温同压下,气体密度之比等于相对分子质量之比;
(6)摩尔质量之比等于相对分子是之比.
解答 解:(1)同温同压下,气体分子数目之比等于体积之比,故1体积的CO2和2体积的CO含有分子数目之比=1:2,故答案为:1:2;
(2)同温同压下,气体体积之比等于物质的量之比,故1体积的CO2和2体积的CO的物质的量之比=1:2,则二者含有原子数目之比=1×3:2×2=3:4,故答案为:3:4;
(3)同温同压下,气体体积之比等于物质的量之比,故1体积的CO2和2体积的CO的物质的量之比=1:2,则二者质量之比=1mol×44g/mol:2mol×28g/mol=11:14,故答案为:11:14;
(4)同温同压下,气体体积之比等于物质的量之比,故答案为:1:2;
(5)同温同压下,气体密度之比等于相对分子质量之比,CO2与CO的密度之比=44:28=11:7,故答案为:11:7;
(6)摩尔质量之比等于相对分子是之比,所以摩尔质量之比为11:7,故答案为:11:7.
点评 本题考查物质的量有关计算、阿伏伽德罗定律及推论,难度不大,根据pV=nRT理解阿伏伽德罗定律及推论.

练习册系列答案
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
11.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | pH=1的溶液中:Mg2+、Na+、AlO2-、SO42- | |
| B. | 无色透明的水溶液中:K+、Mg2+、I-、Cl- | |
| C. | 含有大量NO3-的溶液中:H+、Na+、Fe2+、Cl- | |
| D. | 含有大量Al3+的溶液中:Ca2+、K+、Cl-、HCO3- |
12.下列装置所示的实验中,能达到实验目的是( )
| A. |  分离碘和酒精 | B. | 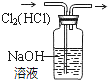 除去CL2中HCL | C. | 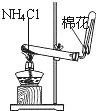 实验室制氨气 | D. | 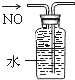 排水法收集NO |
16.下列说法中错误的是( )
| A. | 在Na2S溶液中滴入酚酞试液,呈红色 | |
| B. | 升高温度能使FeCl3溶液中的H+浓度增大 | |
| C. | 一切钾盐、钠盐、硝酸盐都不发生水解 | |
| D. | 醋酸盐溶于水能发生水解 |
6.下列图象能正确反映对应的实验操作的是( )
| A. |  向一定量的饱和石灰水中加入氧化钙 | |
| B. | 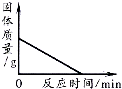 加热一定量高锰酸钾固体产生氧气 | |
| C. | 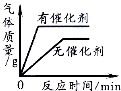 用一定量的双氧水制取氧气 | |
| D. | 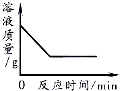 向一定量的硝酸银溶液中插入铜丝 |
13.下列物质中属于碱性氧化物的是( )
| A. | CO2 | B. | Na2O | C. | Na2O2 | D. | FeSO4 |
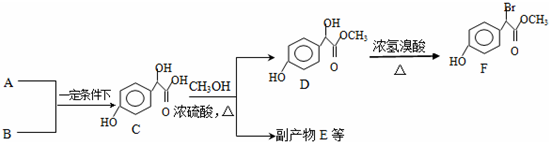
 .
. 中①、②、③(从左到右编号)3个-OH的酸性由强到弱的顺序是:③>①>②.
中①、②、③(从左到右编号)3个-OH的酸性由强到弱的顺序是:③>①>②. .
.