题目内容
3.在一定条件下,某化合物W受热分解:2W$\frac{\underline{\;△\;}}{\;}$A↑+2B↑+4C↑,测得反应后生成的混合气体是相同条件下等体积H2质量的11.43倍,则W的摩尔质量是( )| A. | 11.43 | B. | 22.86g/mol | C. | 80.01 | D. | 80.01g/mol |
分析 令W的物质的量为2mol,由方程式可知混合气体总物质的量为7mol,根据混合气体相对氢气密度计算混合气体的平均摩尔质量,根据m=nM计算混合气体总质量,由质量守恒定律可知W的质量等于混合气体总质量,再根据M=$\frac{m}{n}$计算W的摩尔质量.
解答 解:令W的物质的量为2mol,由方程式2W$\frac{\underline{\;△\;}}{\;}$A↑+2B↑+4C↑,可知混合气体总物质的量为1mol+2mol+4mol=7mol,
混合气体对氢气的相对密度为11.43,则混合气体平均摩尔质量=2g/mol×11.43=22.86g/mol,混合气体总质量=7mol×22.86g/mol,由质量守恒定律可知W的质量等于混合气体总质量,故W的摩尔质量=$\frac{7mol×22.86g/mol}{2mol}$=80.01g/mol,
故选D.
点评 本题考查物质的量计算、化学方程式计算,难度不大,关键是理解相同条件下气体的摩尔质量和气体的密度成正比,注意掌握摩尔质量的计算方法.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
13.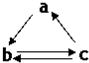 下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
 下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )| a | b | c | |
| A | Al | AlCl3 | Al(OH)3 |
| B | HNO3 | NO | NO2 |
| C | Si | SiO2 | H2SiO3 |
| D | SO3 | H2SO4 | S |
| A. | A | B. | B | C. | C | D. | D |
11.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | pH=1的溶液中:Mg2+、Na+、AlO2-、SO42- | |
| B. | 无色透明的水溶液中:K+、Mg2+、I-、Cl- | |
| C. | 含有大量NO3-的溶液中:H+、Na+、Fe2+、Cl- | |
| D. | 含有大量Al3+的溶液中:Ca2+、K+、Cl-、HCO3- |
18.下列叙述中错误的是( )
| A. | 葡萄糖和果糖互为同分异构体 | |
| B. | 淀粉、油脂、蛋白质均能发生水解反应 | |
| C. | 乙醇可使酸性高锰酸钾溶液褪色 | |
| D. | 苯和溴水在FeBr3的条件下可制得溴苯 |
8.下列除杂方法正确的是( )
①除去乙烷中少量的乙烯:通入H2,加催化剂反应
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液
③除去NaBr溶液中的NaI:用氯水氧化NaI,再用CCl4萃取分液
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏
⑤只含有泥沙的粗盐:可通过溶解、过滤、蒸发、结晶的方法提纯.
①除去乙烷中少量的乙烯:通入H2,加催化剂反应
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液
③除去NaBr溶液中的NaI:用氯水氧化NaI,再用CCl4萃取分液
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏
⑤只含有泥沙的粗盐:可通过溶解、过滤、蒸发、结晶的方法提纯.
| A. | ①②③ | B. | ②④⑤ | C. | ③④⑤ | D. | ②③④ |
15.下列说法或表示法正确的是( )
| A. | 等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 由C(石墨)═C(金刚石)△H>0,可知金刚石比石墨稳定 | |
| C. | 在稀溶液 中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ | |
| D. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 |
12.下列装置所示的实验中,能达到实验目的是( )
| A. |  分离碘和酒精 | B. | 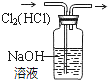 除去CL2中HCL | C. | 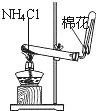 实验室制氨气 | D. | 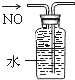 排水法收集NO |
13.下列物质中属于碱性氧化物的是( )
| A. | CO2 | B. | Na2O | C. | Na2O2 | D. | FeSO4 |