题目内容
14.下列化学表述正确的是( )| A. | 氯化钠的晶体模型: | |
| B. | 铍原子最外层的电子云图: | |
| C. | 次氯酸的结构式:H-O-Cl | |
| D. | CH3CHOHCH(CH3)2名称:2-3-二甲基丙醇 |
分析 A.在氯化钠晶体中,每个氯离子的周围都有6个钠离子,每个钠离子的周围也有6个氯离子,钠离子半径小于氯离子半径;
B.铍原子最外层为s能级,s能级的电子云图为球形;
C.次氯酸是共价化合物,氧原子与氢原子、氯原子分别通过1对共用电子对结合,结构式为H-O-Cl;
D.丙醇命名出现了3-甲基,说明主链不是最长的.
解答 解:A.氯化钠晶体中,钠离子的离子半径比氯离子半径小,正确的氯化钠晶体为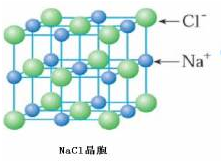 ,故A错误;
,故A错误;
B.铍原子最外层为s能级,s能级的电子云图为球形: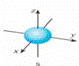 ,故B错误;
,故B错误;
C.次氯酸是共价化合物,氧原子与氢原子、氯原子分别通过1对共用电子对结合,结构式为H-O-Cl,故C正确;
D.命名出现了3-甲基,说明主链不是最长的,正确命名为:3-甲基-2-丁醇,故D错误;
故选C.
点评 本题考查了常见化学用语的判断,题目难度中等,试题涉及了晶体结构、电子云图、结构式、命名等知识,注意明确常见化学用语的正确表示方法,选项D为易错点.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
4.可逆反应H2(g)+I2(g)?2HI(g)达到平衡的标志是( )
| A. | H2、I2、HI的浓度相等 | B. | H2、I2、HI的浓度之比为1:1:2 | ||
| C. | 混合气体的平均相对分子质量不变 | D. | 混合气体的颜色不再改变 |
5.已知Ksp(AgCl)>Ksp(AgBr)>Ksp(AgI).在某溶液中含有等物质的量浓度的Cl-、Br-、I-,当逐滴加入AgNO3溶液,沉淀先后出现的顺序是( )
| A. | AgI,AgBr,AgCl | B. | AgCl,AgI,AgBr | C. | AgBr,AgI,AgCl | D. | AgCl,AgBr,AgI |
2.下列解释事实的方程式不正确的是( )
| A. | 测得0.1mol/L的氨水的pH为11:NH3•H2O?NH4++OH- | |
| B. | 在H2O2溶液中,滴加FeCl3溶液产生气泡:2H2O2+2Cl-=2H2O+O2↑+Cl2↑ | |
| C. | 用CuCl2溶液做导电性试验,灯泡发光:CuCl2=Cu2++2Cl- | |
| D. | 向Cu(OH)2悬浊液中滴加Na2S溶液,蓝色沉淀变黑:Cu(OH)2 (s)+S2-?CuS (s)+2 OH- |
9.某澄清溶液中可能含有下列离子:K+、NH4+、Fe2+、Fe3+、Ba2+、SO42ˉ、HCO3ˉ、Clˉ,
为鉴别其中含有的离子,进行如下实验:
①用玻璃棒蘸取原溶液滴在pH试纸上,试纸显红色;
②另取少量原溶液加入BaCl2溶液,生成不溶于稀硝酸的白色沉淀;
③取②中上层清液加入酸化的硝酸银溶液,生成白色沉淀.
下列关于原溶液的说法正确的是( )
为鉴别其中含有的离子,进行如下实验:
①用玻璃棒蘸取原溶液滴在pH试纸上,试纸显红色;
②另取少量原溶液加入BaCl2溶液,生成不溶于稀硝酸的白色沉淀;
③取②中上层清液加入酸化的硝酸银溶液,生成白色沉淀.
下列关于原溶液的说法正确的是( )
| A. | 原溶液中一定不存在Ba2+和HCO3- | |
| B. | 取③中滤液加入KSCN,溶液显红色,则原溶液一定有Fe3+ | |
| C. | 原溶液中一定存在SO42-和Cl- | |
| D. | 为确定原溶液中是否含有K+,可通过焰色反应直接观察焰色是否为紫色来确定 |
19.已知:S(s)+O2(g)→SO2(g)+297.16kJ,2SO2(g)+O2(g)?2SO3(g)+196.6kJ,下列说法正确的是( )
| A. | 1 molSO2(g)的能量总和大于lmol S(s)和l molO2(g)的能量总和 | |
| B. | 将2 molSO2(g)与l molO2(g)在一定条件下充分反应,放出196.6kJ的热量 | |
| C. | S(g)+O2(g)→SO2(g)+Q,Q值小于297.16 kJ | |
| D. | 当l mol S(s)完全转化为SO3(g)时(假设无热量损失),放出395.46kJ的热量 |
6.为了测定铜铁合金中铜的质量分数,在10.00g试样中加入200mL、0.6mol/L的稀硝酸,充分反应后剩余金属7.48g,再向其中加入50mL、0.4mol/L的稀硫酸,充分振荡后剩余金属6.60g.若硝酸的还原产物只有NO,下列说法正确的是( )
| A. | 上述测定不能达到实验目的 | B. | 剩余的7.48g金属为铜 | ||
| C. | 共生成NO气体 0.04mol | D. | 该合金中铜的质量分数为69.2% |
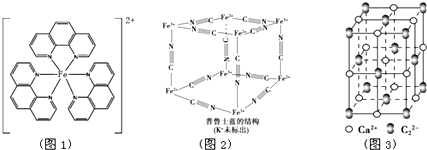
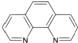 ),它能与Fe2+形成红色配合物(如图1),该配离子中Fe2+与氮原子形成配位键共有6个.
),它能与Fe2+形成红色配合物(如图1),该配离子中Fe2+与氮原子形成配位键共有6个. .已知CaC2晶体密度为ag•cm-3,NA表示阿伏加德罗常数,则CaC2晶胞体积为$\frac{256}{a{N}_{A}}$cm3.
.已知CaC2晶体密度为ag•cm-3,NA表示阿伏加德罗常数,则CaC2晶胞体积为$\frac{256}{a{N}_{A}}$cm3.