题目内容
19.已知:S(s)+O2(g)→SO2(g)+297.16kJ,2SO2(g)+O2(g)?2SO3(g)+196.6kJ,下列说法正确的是( )| A. | 1 molSO2(g)的能量总和大于lmol S(s)和l molO2(g)的能量总和 | |
| B. | 将2 molSO2(g)与l molO2(g)在一定条件下充分反应,放出196.6kJ的热量 | |
| C. | S(g)+O2(g)→SO2(g)+Q,Q值小于297.16 kJ | |
| D. | 当l mol S(s)完全转化为SO3(g)时(假设无热量损失),放出395.46kJ的热量 |
分析 A、根据S(s)+O2(g)→SO2(g)+297.16kJ可知,1molSO2(g)的能量总和小于lmol S(s)和l molO2(g)的能量总和;
B、2 molSO2(g)与l molO2(g)置于密闭容器中,2SO2(g)+O2(g)?2SO3(g)是可逆反应不可能完全转化,所以放出热量应小于196.6kJ;
C、硫固体变成气体要吸热;
D、根据①S(s)+O2(g)→SO2(g)+297.16kJ,②2SO2(g)+O2(g)?2SO3(g)+196.6kJ,由盖斯定律①+②×$\frac{1}{2}$计算.
解答 解:A、因为S(s)+O2(g)→SO2(g)+297.16kJ可知该反应放热,所以1molSO2(g)的能量总和小于lmol S(s)和l molO2(g)的能量总和,故A错误;
B、2 molSO2(g)与l molO2(g)置于密闭容器中,2SO2(g)+O2(g)?2SO3(g)是可逆反应不可能完全转化,所以放出热量应小于196.6kJ,故B错误;
C、因为硫固体变成气体要吸热,所以S(g)+O2(g)→SO2(g)+Q,Q值大于297.16 kJ,故C错误;
D、根据①S(s)+O2(g)→SO2(g)+297.16kJ,②2SO2(g)+O2(g)?2SO3(g)+196.6kJ,由盖斯定律①+②×$\frac{1}{2}$得,l mol S(s)完全转化为SO3(g)时(假设无热量损失),放出297.16+196.6×$\frac{1}{2}$=395.46kJ的热量,故D正确.
故选D.
点评 本题考查化学反应速率的影响因素,为高频考点,侧重于学生的分析能力和基础知识的综合理解和运用的考查,注意相关基础知识的积累,难度不大,注意把握影响化学反应速率的因素与影响原因的关系.

| A. | 7 g | B. | 14 g | C. | 28 g | D. | 无法计算 |
| A. | C02与CaO化合是放热反应,则CaC03分解是吸热反应 | |
| B. | 只有分解反应才是吸热反应 | |
| C. | 使用催化剂的反应是吸热反应 | |
| D. | 凡需加热的反应一定是吸热反应 |
| A. | 氯化钠的晶体模型: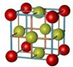 | |
| B. | 铍原子最外层的电子云图: | |
| C. | 次氯酸的结构式:H-O-Cl | |
| D. | CH3CHOHCH(CH3)2名称:2-3-二甲基丙醇 |
| A. | c(Na+)+c(H+)=c(HRO3-)+2c(RO32-)+c(OH-) | B. | c(H+)+c(H2RO3)=c(RO32-)+c(OH-) | ||
| C. | c(Na+)>c(HRO3-)>c(H+)>c(OH-)>c(RO32-) | D. | c(HRO3-)>c(H2RO3)>c(OH-)>c(RO32-)>c(H+) |
| A. | 常温下,10L pH=1的硫酸溶液中含有的H+数为NA | |
| B. | 将58.5g NaCl溶于1.00L水中,所得NaCl溶液的浓度为1.00mol•L-1 | |
| C. | 1molCl2与足量的铁反应,转移的电子数为3NA | |
| D. | 1molAl3+含有的核外电子数为3NA |
| A. | 10mL 20mL | B. | 20mL 30mL | C. | 10mL 36.7mL | D. | 20mL 36.7mL |