题目内容
5.已知Ksp(AgCl)>Ksp(AgBr)>Ksp(AgI).在某溶液中含有等物质的量浓度的Cl-、Br-、I-,当逐滴加入AgNO3溶液,沉淀先后出现的顺序是( )| A. | AgI,AgBr,AgCl | B. | AgCl,AgI,AgBr | C. | AgBr,AgI,AgCl | D. | AgCl,AgBr,AgI |
分析 组成相似的难溶电解质,溶解度与溶度积成正比,则Ksp越大溶解度越大;当含有等物质的量浓度的Cl-、Br-、I-,逐滴加入AgNO3溶液时,溶解度较小的首先沉淀,也可以利用浓度积与Ksp关系解决此问题.
解答 解:方法①:利用组成相似的难溶电解质,溶解度与溶度积成正比,即Ksp越大溶解度越大.所以AgCl、AgBr、AgI溶解度逐渐减小.沉淀顺序为AgI、AgBr、AgCl,即A正确;
方法②:等物质的量浓度的Cl-、Br-、I-,逐滴加入AgNO3溶液时AgCl、AgBr、AgI三者的浓度积Qc相等,因为Ksp(AgI)最小,所以首先Qc>Ksp的为AgI,其次为AgBr,最后为AgCl,则沉淀顺序为:AgI、AgBr、AgCl,即A确,
故选A.
点评 本题考查难溶电解质的沉淀出现与Ksp或者溶解度有关系,题目难度不大,明确溶度积与沉淀的转化、生成和溶解的关系为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
相关题目
15.合理开发和利用海水资源是世界各国研究的课题.下列对于海水利用的认识错误的是( )
| A. | 海水中蕴藏有丰富的资源,人类可以大量开发,以弥补资源的短缺 | |
| B. | 海水可以成为廉价的资源基地,但要合理开发,综合利用 | |
| C. | 可以用太阳能电解海水以获取氢能源 | |
| D. | 人类在利用海水时要兼顾海洋生物和海洋生态平衡 |
16.下列推断正确的是( )
| A. | SiO2是酸性氧化物,能与NaOH溶液反应 | |
| B. | Na2CO3、NaHCO3都是盐,都能与CaCl2溶液反应 | |
| C. | CO、NO都是大气污染气体,在空气中都能稳定存在 | |
| D. | Fe和Al都是金属,都不能与碱溶液反应 |
20.下列状态下,不能导电的强电解质是( )
| A. | 冰醋酸 | B. | 纯硫酸 | C. | 蔗糖溶液 | D. | 氢氧化钠溶液 |
17.海洋资源的开发与利用具有广阔的前景.海水的pH一般在7.5~8.6之间,某地海水中主要离子的含量如下表:
(1)海水显弱碱性的原因是(用离子方程式表示)HCO3-+H2O?H2CO3+OH-.该海水中Ca2+的物质的量浓度为5×10-3 mol•L-1.
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图1所示.其中阴(阳)离子交换膜只允许阴(阳)离子通过.
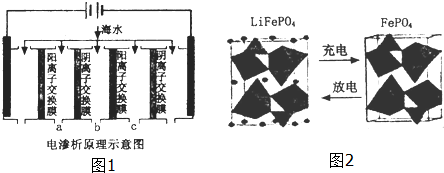
①阴极的电极反应式为2H++2e-=H2↑.
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式
Ca2++OH-+HCO3-=CaCO3↓+H2O.
③淡水的出口为a、b、c中的b出口.
(3)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力.锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如图2所示:
该电池电解质为能传导Li+的固体材料.放电时该电极是电池的正极(填“正”或“负”),电极反应式为FePO4+e-+Li+=LiFePO4.
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| 含量/mg•L-1 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图1所示.其中阴(阳)离子交换膜只允许阴(阳)离子通过.

①阴极的电极反应式为2H++2e-=H2↑.
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式
Ca2++OH-+HCO3-=CaCO3↓+H2O.
③淡水的出口为a、b、c中的b出口.
(3)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力.锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如图2所示:
该电池电解质为能传导Li+的固体材料.放电时该电极是电池的正极(填“正”或“负”),电极反应式为FePO4+e-+Li+=LiFePO4.
14.下列化学表述正确的是( )
| A. | 氯化钠的晶体模型: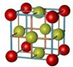 | |
| B. | 铍原子最外层的电子云图: | |
| C. | 次氯酸的结构式:H-O-Cl | |
| D. | CH3CHOHCH(CH3)2名称:2-3-二甲基丙醇 |
15.A、B、C、D、E为短周期元素,其原子序数依次增大.其中A的最外层电子数为其周期数的2倍;B和D为同主族元素,其中B的氢化物在常温下为液态;C的+1价离子比E的-1价离子少8个电子.则下列说法正确的是( )
| A. | D氢化物的稳定性比B氢化物的稳定性强 | |
| B. | 5种元素中,E元素氧化物的水合物的酸性最强 | |
| C. | A与B、D分别可形成AB2、AD2的化合物 | |
| D. | B和C可形成离子化合物,且C离子的半径大于B离子的半径 |