题目内容
6.为了测定铜铁合金中铜的质量分数,在10.00g试样中加入200mL、0.6mol/L的稀硝酸,充分反应后剩余金属7.48g,再向其中加入50mL、0.4mol/L的稀硫酸,充分振荡后剩余金属6.60g.若硝酸的还原产物只有NO,下列说法正确的是( )| A. | 上述测定不能达到实验目的 | B. | 剩余的7.48g金属为铜 | ||
| C. | 共生成NO气体 0.04mol | D. | 该合金中铜的质量分数为69.2% |
分析 每次均有金属剩余,说明反应后溶液中一定没有Fe3+,肯定有Fe2+,发生反应方程式为:3Cu+8H++NO3-=3Cu2++2NO↑+4H2O,3Fe+8H++NO3-=3Fe2++2NO↑+4H2O,
而有金属剩余,则反应后溶液中必然不含H+,而NO3-只有$\frac{1}{4}$被还原:0.12mol×$\frac{1}{4}$=0.03mol,根据固体质量变化判断第一次溶解金属情况;
第二次又加入H+为:0.05L×0.4mol/L×2=0.04mol,从方程式看出又有0.01mol的NO3-进一步被还原,设出铜和铁的物质的量,然后根据质量变化及氢离子的物质的量列式计算出第二次溶解的金属,从而得出合金中各组分的含量、生成一氧化氮的物质的量、铜的质量分数.
解答 解:每次均有金属剩余,说明反应后溶液中肯定没有Fe3+,肯定有Fe2+,发生反应:
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
3 8 2
3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
3 8 2
第一次加入H+和NO3-均为:0.2L×0.6mol/L=0.12mol,而有金属剩余,知道反应后溶液中必然不含H+,而NO3-只有$\frac{1}{4}$被还原:0.12mol×$\frac{1}{4}$=0.03mol,
消耗的金属的物质的量为:0.12mol×$\frac{3}{8}$=0.045mol,如果溶解的金属全部为Fe,则消耗金属的质量为:56g/mol×0.045g=2.52g,
而金属减少的质量为:10.0g-7.48g=2.52g,则第一次溶解的只有Fe,Cu没有参与反应;
第二次又加入H+为:0.05L×0.4mol/L×2=0.04mol,根据方程式可知又有0.01mol的NO3-进一步被还原,而如果金属全部消耗的是Fe,则金属必然减少:56g/mol×$\frac{3}{8}$×0.04mol=0.84g<7.48g-6.60g=0.88g;
而如果金属消耗的都是Cu,则金属减少:64g/mol×$\frac{3}{8}$×0.02mol=0.96g>7.48g-6.60g=0.88g,说明第二次消耗的金属为Fe和Cu;
则第一次反应后剩余的7.48g金属为Fe和Cu的混合物,6.60g完全为Cu,
设第二次溶解的铁的物质的量为xmol、铜的物质的量为ymol,则:①xmol+ymol=$\frac{3}{8}$×0.04mol=0.015mol;
根据金属质量变化可知:②56g/mol×xmol+64g/mol×ymol=7.48g-6.60g=0.88g,
根据①②解得:x=0.01,y=0.005,
则混合物中Cu的质量为:6.60g+64g/mol×0.005mol=6.92g,
A.由以上分析可知,可以计算出混合物中含有6.92g铜,从而得出合金中各组分的含量,故A错误;
B.剩余的7.48g为铁和铜的混合物,故B错误;
C.根据反应方程式可知,生成一氧化氮的物质的量为反应的氢离子总物质的量的$\frac{1}{4}$,则:n(NO)=$\frac{1}{4}$(0.12mol+0.04mol)=0.04mol,故C正确;
D.根据计算可知,合金中含有6.92g铜,则铜的质量分数为:$\frac{6.92g}{10g}$×100%=69.2%,故D正确;
故选CD.
点评 本题考查混合物的有关计算,题目难度较大,判断第一次剩余的金属组成是解题的关键,是对学生综合能力的考查,正确书写反应的离子方程式为解答本题前提,试题充分考查了学生的理解能力及化学计算能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | SiO2是酸性氧化物,能与NaOH溶液反应 | |
| B. | Na2CO3、NaHCO3都是盐,都能与CaCl2溶液反应 | |
| C. | CO、NO都是大气污染气体,在空气中都能稳定存在 | |
| D. | Fe和Al都是金属,都不能与碱溶液反应 |
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| 含量/mg•L-1 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图1所示.其中阴(阳)离子交换膜只允许阴(阳)离子通过.
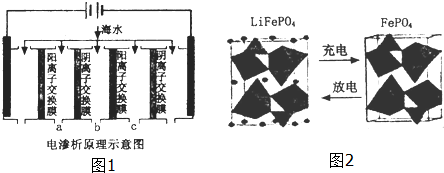
①阴极的电极反应式为2H++2e-=H2↑.
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式
Ca2++OH-+HCO3-=CaCO3↓+H2O.
③淡水的出口为a、b、c中的b出口.
(3)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力.锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如图2所示:
该电池电解质为能传导Li+的固体材料.放电时该电极是电池的正极(填“正”或“负”),电极反应式为FePO4+e-+Li+=LiFePO4.
| A. | 氯化钠的晶体模型: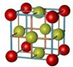 | |
| B. | 铍原子最外层的电子云图: | |
| C. | 次氯酸的结构式:H-O-Cl | |
| D. | CH3CHOHCH(CH3)2名称:2-3-二甲基丙醇 |
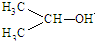 可简写为
可简写为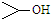 .达菲是世界卫生组织推荐的抗禽流感药物,其结构简式如图(
.达菲是世界卫生组织推荐的抗禽流感药物,其结构简式如图(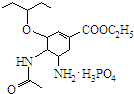 ),有关它的说法错误的是( )
),有关它的说法错误的是( )| A. | 达菲是一种磷酸盐 | |
| B. | 达菲分子中含有肽键 | |
| C. | 达菲的分子式为C16H31N2O8P | |
| D. | 1mol达菲可与2mol H2发生加成反应 |
| A. | 常温下,10L pH=1的硫酸溶液中含有的H+数为NA | |
| B. | 将58.5g NaCl溶于1.00L水中,所得NaCl溶液的浓度为1.00mol•L-1 | |
| C. | 1molCl2与足量的铁反应,转移的电子数为3NA | |
| D. | 1molAl3+含有的核外电子数为3NA |
| A. | 28g N2、N2O、N2O4的混合气体含有氮原子数为2NA | |
| B. | 质量均为7.8 g Na2S、Na2O2的固体中含有的阴离子数均为0.1NA | |
| C. | 0.5 mol•L-1的乙酸溶液中,乙酸分子的数目小于0.5NA | |
| D. | 78g苯分子中含有碳碳双键数为3 NA |
| A. | D氢化物的稳定性比B氢化物的稳定性强 | |
| B. | 5种元素中,E元素氧化物的水合物的酸性最强 | |
| C. | A与B、D分别可形成AB2、AD2的化合物 | |
| D. | B和C可形成离子化合物,且C离子的半径大于B离子的半径 |
