题目内容
4.0.4g氢氧化钠溶液溶于水,配成100毫升溶液.(1)求其pH.
(2)若将上述溶液稀释100倍,则求其pH.
(3)若在原溶液中加入pH等于2的盐酸,盐酸体积为多少时,与氢氧化钠正好完全反应.
分析 (1)根据n=$\frac{m}{M}$、c(OH-)=$\frac{n}{V}$、c(H+)=$\frac{Kw}{c(O{H}^{-})}$来分析计算;
(2)c(OH-)浓•V浓=c(OH-)稀•V稀;
(3)酸碱恰好中和时氢离子的物质的量等于氢氧根离子的物质的量.
解答 解:(1)4.0g氢氧化钠的物质的量为$\frac{0.4g}{40g/mol}$=0.01mol,
配成100毫升溶液,则溶液的体积为100mL即0.1L,
则c=$\frac{0.01mol}{0.1L}$=0.1mol/L,c(H+)=$\frac{Kw}{c(O{H}^{-})}$=$\frac{1{0}^{-14}}{0.1}$mol/L=10-13mol/L,所以pH=13;
答:溶液的pH为13;
(2)c(OH-)浓•V浓=c(OH-)稀•V稀,则0.1mol/L×0.1L=c×100×0.1L,则c=0.001mol/L,所以c(H+)=$\frac{Kw}{c(O{H}^{-})}$=10-11mol/L,所以pH=11;
答:所得溶液的pH为11;
(3)酸碱恰好中和时氢离子的物质的量等于氢氧根离子的物质的量,即c(H+)×V(H+)=c(OH-)×V(OH-),则0.01mol/L×V=0.01mol,解得V=1L;
答:盐酸的体积为1L.
点评 本题考查物质的量浓度的计算和pH的计算,熟悉计算公式即可解答,题目难度不大,注意把握碱溶液中pH的计算方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.下列化学表述正确的是( )
| A. | 氯化钠的晶体模型: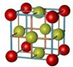 | |
| B. | 铍原子最外层的电子云图: | |
| C. | 次氯酸的结构式:H-O-Cl | |
| D. | CH3CHOHCH(CH3)2名称:2-3-二甲基丙醇 |
15.A、B、C、D、E为短周期元素,其原子序数依次增大.其中A的最外层电子数为其周期数的2倍;B和D为同主族元素,其中B的氢化物在常温下为液态;C的+1价离子比E的-1价离子少8个电子.则下列说法正确的是( )
| A. | D氢化物的稳定性比B氢化物的稳定性强 | |
| B. | 5种元素中,E元素氧化物的水合物的酸性最强 | |
| C. | A与B、D分别可形成AB2、AD2的化合物 | |
| D. | B和C可形成离子化合物,且C离子的半径大于B离子的半径 |
19.对于化学反应A+B═C+D的下列说法中正确的是( )
| A. | 若生成物C和D分别为盐和水,则该反应一定是中和反应 | |
| B. | 若A和C是单质,B和D是化合物,则该反应一定是置换反应 | |
| C. | 若A是可溶性碱,B是可溶性盐,则C和D不可能是两种沉淀 | |
| D. | 若A是可溶性碱,B是可溶性盐,则C和D一定是另一种碱和另一种盐 |
9.向10mL 1mol•L-1 AlCl3溶液中加入1mol•L-1 NaOH溶液,得到沉淀0.26g,则刚加入的NaOH溶液的体积可能为( )
| A. | 10mL 20mL | B. | 20mL 30mL | C. | 10mL 36.7mL | D. | 20mL 36.7mL |
3.已知:①2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1
②N2(g)+2O2(g)═2NO2(g)△H=+67.8kJ•mol-1
③N2(g)+3H2(g)═2NH3(g)△H=-92.0kJ•mol-1
则4NH3(g)+7O2(g)═4NO2(g)+6H2O(g)△H=XkJ•mol-1中X的值是( )
②N2(g)+2O2(g)═2NO2(g)△H=+67.8kJ•mol-1
③N2(g)+3H2(g)═2NH3(g)△H=-92.0kJ•mol-1
则4NH3(g)+7O2(g)═4NO2(g)+6H2O(g)△H=XkJ•mol-1中X的值是( )
| A. | -1131.2 | B. | -647.6 | C. | -507.8 | D. | -323.8 |
4.工业上用洗净的废铜屑作原料来制备硝酸铜,为了节约原料,宜采取的方法是( )
| A. | Cu+HNO3(浓)→Cu(NO3)2 | |
| B. | Cu+HNO3(稀)→Cu(NO3)2 | |
| C. | Cu$→_{△}^{空气}$Cu$\stackrel{HNO_{3}}{→}$Cu(NO3)2 | |
| D. | Cu $→_{△}^{浓硫酸}$ CuSO4$\stackrel{Ba(NO_{3})_{2}}{→}$Cu(NO3)2 |
