题目内容
17.下列说法正确的是( )| A. | 将三氯化铁溶液蒸干,可制得无水三氯化铁 | |
| B. | 明矾能水解生成Al(OH)3胶体,可用作净水剂,说明Al(OH)3具有漂白性 | |
| C. | 含1molKOH的溶液与1molCO2完全反应后,溶液中c(K+)=c(HCO3-) | |
| D. | 在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-) |
分析 A、氯化铁溶液中存在平衡Fe3++3H2O?Fe(OH)3+3HCl,加热HCl挥发,促进水解彻底进行;
B、明矾净水是利用铝离子水解生成的氢氧化铝胶体具有悬浮杂质的作用;
C、含1molKOH的溶液与1molCO2完全反应生成KHCO3,HCO3-离子水解减小;
D、在CH3COONa溶液中加入适量CH3COOH可以使溶液呈中性,结合电荷守恒分析.
解答 解:A、氯化铁溶液中存在平衡Fe3++3H2O?Fe(OH)3+3HCl,加热HCl挥发,促进水解彻底进行,将三氯化铁溶液蒸干,可制得Fe(OH)3,不能获得无水三氯化铁,故A错误;
B、明矾中的铝离子水解生成氢氧化铝胶体具有吸附悬浮杂质的作用,不是漂白作用,故B错误;
C、含1molKOH的溶液与1molCO2完全反应生成KHCO3,CO2+KOH=KHCO3,溶液中HCO3-离子水解减小,c(K+)>c(HCO3-),故C错误;
D、在CH3COONa溶液中加入适量CH3COOH可以使溶液呈中性,存在电荷守恒c(H+)+c(Na+)=c(OH-)+c(CH3COO-),c(H+)=c(OH-),c(Na+)=c(CH3COO-),故D正确;
故选D.
点评 本题考查了盐类水解的分析判断,电解质溶液中得到溶质的方法和产物判断,主要是电解质溶液中电荷守恒的分析应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
7.下列说法或表达正确的是( )
| A. | 乙醇、糖类和蛋白质都是人体必需的营养物质 | |
| B. | 石油是混合物,其分馏产品汽油也是混合物 | |
| C. | “海水淡化”可以解决“淡水供应危机”,加入明矾可以使海水淡化 | |
| D. | 陶瓷、水晶、水泥、玻璃都属于硅酸盐 |
8.下列各组离子在溶液中能大量共存的是( )
| A. | K+、OH-、Na+、NO3- | B. | Al3+、AlO2-、HCO3-、Na+ | ||
| C. | Na+、Fe3+、SO42-、I- | D. | Fe3+、SCN-、Na+、CO32- |
5.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1 mol•L-1NH4HCO3溶液:K+、Na+、SO42-、OH- | |
| B. | 能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3- | |
| C. | 0.1 mol•L-1CH3COONa溶液:Mg2+、H+、Cl-、SO42- | |
| D. | Kw/c(H+)=0.1 mol•L-1的溶液:Na+、K+、SiO32-、NO3- |
2.某同学组装了如图所示的电化学装置,则下列说法正确的是( )
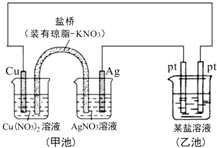

| A. | 图中甲池为原电池装置,Cu电极发生还原反应 | |
| B. | 实验过程中,甲池左侧烧杯中NO3-的浓度不变 | |
| C. | 若甲池中Ag电极质量增加5.4g时,乙池某电极析出1.6g金属,则乙中的某盐溶液可能是AgNO3溶液 | |
| D. | 若用铜制U形物代替“盐桥”,工作一段时间后取出U形物称量,质量会减小 |
9.已知:某温度时,KW=1.0×10-12.在该温度下,测得0.1mol•L-1Na2A溶液pH=6,则下列说法正确的是( )
| A. | H2A在水溶液中的电离方程式为:H2A=H++HA-,HA-?H++A2- | |
| B. | 常温下,NH4HA溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(A2-) | |
| C. | 相同条件下,体积相等、pH相等的盐酸与H2A溶液中和NaOH的量相等 | |
| D. | 0.0l mol•L-l的NaHA溶液pH>2 |
6.下列各晶体中任意一个原子都被相邻的4个原子所包围:以共价键结合成正四面体结构,并向空间伸展成网状结构的是( )
| A. | 甲烷 | B. | 石墨 | C. | 晶体硅 | D. | 水晶 |