题目内容
12.工业上以浓缩海水为原料提取溴的部分流程如图1:
已知:Br2常温下呈液态,易挥发,有毒;3Br2+3CO32-═5Br-+BrO3-+3CO2.
(1)上述流程中,步骤①~③的目的是使海水中的溴元素富集.
(2)反应釜2中发生反应的离子方程式为5Br-+BrO3-+6H+═3Br2+3H2O.
(3)实验室使用右图所示装置模拟上述过程.A装置中先通入Cl2一段时间后,再通入热空气.通入热空气的目的是使A中Br2进入B瓶中;B装置中导管D的作用是平衡压强;C装置中溶液X为NaOH溶液或Na2CO3溶液.
(4)对反应后烧瓶B中的溶液进行如下实验,请补充完整相关实验步骤.限选用的试剂为:稀硫酸、四氯化碳、澄清石灰水.
①检验烧瓶B的溶液中是否含有CO32-.取烧瓶B中的溶液适量,加入试管中,再加入过量的稀硫酸酸化;将酸化后产生的气体通过盛有四氯化碳的洗气瓶后,再通入澄清石灰水中,若石灰水变浑浊,则证明烧瓶B的溶液中含有CO32-.
②提取反应后烧瓶B溶液中的溴单质.向烧瓶B中加入过量的稀硫酸酸化;然后用四氯化碳进行萃取并分液后蒸馏,从而得到溴单质.
分析 (1)步骤①中用氯气将溴离子氧化成溴单质,步骤②将溴单质吹出,步骤③中用碳酸钠溶液吸收溴单质,从而提高了溴离子的浓度;
(2)反应釜2中溴离子、溴酸根离子在酸性条件下反应生成溴单质,据此写出反应的离子方程式;
(3)通入热空气能将溴从蒸馏烧瓶A中吹出;B装置中导管D起到了平衡压强、防止倒吸的作用;尾气中含有有毒的氯气或溴,需要用碱液吸收;(4)①根据是否生成二氧化碳判断溶液中是否含有碳酸根离子;
②溴单质微溶于水,易溶于有机溶剂,据此可通过分液、蒸馏操作分离出溴单质.
解答 解:(1)海水中溴离子浓度较小,通过步骤①中氯气和与溴化钠反应生成溴:Cl2+2Br-=Br2+2Cl-;步骤②将溴单质吹出,步骤③中用碳酸钠溶液吸收溴单质:3Br2+3CO32-═5Br-+BrO3-+3CO2,从而提高了溴离子的浓度,使海水中的溴元素富集,
故答案为:使海水中的溴元素富集;
(2)反应釜2中Br-、BrO3-反应生成溴单质,反应的离子方程式为:5Br-+BrO3-+6H+═3Br2+3H2O,故答案为:5Br-+BrO3-+6H+═3Br2+3H2O;
(3)通入热空气能将溴从蒸馏烧瓶A中吹出,使A中Br2进入B瓶中;B装置中导管D与大气相通,起到了平衡压强、防止倒吸的作用;尾气中含有有毒的氯气或溴,需要用碱液吸收,则X可以为NaOH溶液或Na2CO3溶液,
故答案为:使A中Br2进入B瓶中;平衡压强;NaOH溶液或Na2CO3溶液;
(4)①检验烧瓶B的溶液中是否含有CO32-的方法为:取烧瓶B中的溶液适量,加入试管中,再加入过量的稀硫酸酸化将酸化后产生的气体通过盛有四氯化碳的洗气瓶后,再通入澄清石灰水中,若石灰水变浑浊,则证明烧瓶B的溶液中含有CO32-,否则不含碳酸根离子,
故答案为:将酸化后产生的气体通过盛有四氯化碳的洗气瓶后,再通入澄清石灰水中,若石灰水变浑浊,则证明烧瓶B的溶液中含有CO32-;
②提取反应后烧瓶B溶液中的溴单质:向烧瓶B中加入过量的稀硫酸酸化,然后用四氯化碳进行萃取并分液后蒸馏,从而得到溴单质,
故答案为:然后用四氯化碳进行萃取并分液后蒸馏,从而得到溴单质.
点评 本题考查了海水资源的综合应用,题目难度中等,根据流程明确实验原理为解答关键,注意掌握化学实验基本操作及应用方法,如:常见离子检验、物质分离与提纯方法,试题侧重考查学生的分析能力及化学实验能力.

 备战中考寒假系列答案
备战中考寒假系列答案| A. | 13种 | B. | 12种 | C. | 14种 | D. | 9种 |
| A. | Cu2+、K+、OH-、SO42- | B. | Na+、Ca2+、HCO3-、Cl- | ||
| C. | NH4+、Al3+、AlO2-、H+ | D. | SO32-、Ba2+、H+、NO3- |
| X | Y | ||
| Z | W | Q |
| A. | X、W能与钠形成摩尔质量相同的化合物,且阴阳离子数比为1:2 | |
| B. | 含X和Z元素的常见化合物为分子晶体 | |
| C. | 氧化物对应的水化物酸性:W<Q | |
| D. | 原子半径大小关系:Q>W>Z>Y |
| A. | Cu与浓硝酸反应制备NO2:3Cu+8H++2NO3-═3Cu2++2NO2↑+4H2O | |
| B. | NH4Al(SO4)2溶液与过量NaOH溶液反应:Al3++4OH-═AlO2-+2H2O | |
| C. | 用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2++2OH-$\stackrel{水浴加热}{→}$CH3COO-+NH4++3NH3+2Ag↓+H2O | |
| D. | 用H2O2从酸化的海带灰浸出液中提取碘:2I-+H2O2═I2+2OH- |
| A. | 将三氯化铁溶液蒸干,可制得无水三氯化铁 | |
| B. | 明矾能水解生成Al(OH)3胶体,可用作净水剂,说明Al(OH)3具有漂白性 | |
| C. | 含1molKOH的溶液与1molCO2完全反应后,溶液中c(K+)=c(HCO3-) | |
| D. | 在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-) |
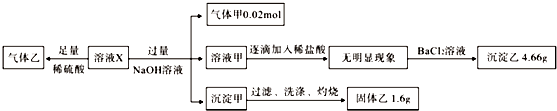
则下列说法正确的是( )
| A. | 若含有Fe3+,则一定含有Cl- | |
| B. | SO42-、NH4+一定存在,NO3-、Cl-可能不存在 | |
| C. | CO32-、Al3+、K+一定不存在 | |
| D. | 气体甲、沉淀甲一定为纯净物 |
| 物质 | CH3OH | CH3OCH3 | H2O |
| c/(mol•L-1) | 0.8 | 1.24 | 1.24 |
| A. | 平衡后升高温度,平衡常数>400 | |
| B. | 平衡时,c(CH3OCH3)=1.6 mol•L-1 | |
| C. | 平衡时,反应混合物的总能量减少40 kJ | |
| D. | 平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率增大 |