题目内容
5.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )| A. | 0.1 mol•L-1NH4HCO3溶液:K+、Na+、SO42-、OH- | |
| B. | 能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3- | |
| C. | 0.1 mol•L-1CH3COONa溶液:Mg2+、H+、Cl-、SO42- | |
| D. | Kw/c(H+)=0.1 mol•L-1的溶液:Na+、K+、SiO32-、NO3- |
分析 A.NH4HCO3溶液与碱反应;
B.能使pH试纸呈红色的溶液,显酸性;
C.CH3COONa溶液,显碱性;
D.Kw/c(H+)=0.1 mol•L-1的溶液显碱性.
解答 解:A.NH4HCO3溶液中不能大量存在OH-,故A不选;
B.能使pH试纸呈红色的溶液,显酸性,H+、I-、NO3-发生氧化还原反应,不能大量共存,故B不选;
C.CH3COONa溶液中不能大量存在H+,故C不选;
D.Kw/c(H+)=0.1 mol•L-1的溶液显碱性,该组离子之间不反应,可大量共存,故D选;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
15.下列实验能达到预期目的是( )
| A. |  用于判断SO2能否与钡盐反应 | B. |  用于判断硼酸、碳酸的酸性强弱 | ||
| C. | 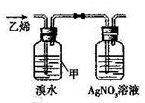 用于判断甲中发生的是加成反应 | D. |  用于AlCl3的蒸发结晶 |
13.几种短周期元素的原子半径及主要化合价如下表,下列说法正确的是( )
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | -- |
| 最低负价 | -- | -1 | -- | -- | -3 | -2 | |
| A. | 元素X和Q形成的化合物中只含有离子键 | |
| B. | X、Z、R的最高价氧化物的水化物之间可两两相互反应 | |
| C. | 用单质Z做的容器不能盛装浓硫酸 | |
| D. | Y的气态氢化物与R的气态氢化物能反应 |
20.短周期元素X、Z、W、Q在元素周期表中的位置如图所示,其中X元素原子最外层电子数是最内层电子数的3倍,则下列说法正确的是( )
| X | Y | ||
| Z | W | Q |
| A. | X、W能与钠形成摩尔质量相同的化合物,且阴阳离子数比为1:2 | |
| B. | 含X和Z元素的常见化合物为分子晶体 | |
| C. | 氧化物对应的水化物酸性:W<Q | |
| D. | 原子半径大小关系:Q>W>Z>Y |
10.一种具有除草功效的有机物的结构简式如图所示.下列有关该化合物的说法正确的是( ) 

| A. | 分子中含有2个手性碳原子 | |
| B. | 能发生氧化、取代、加成反应 | |
| C. | 1 mol该化合物与足量浓溴水反应,最多消耗3 mol Br2 | |
| D. | 1 mol该化合物与足量NaOH溶液反应,最多消耗4 mol NaOH |
17.下列说法正确的是( )
| A. | 将三氯化铁溶液蒸干,可制得无水三氯化铁 | |
| B. | 明矾能水解生成Al(OH)3胶体,可用作净水剂,说明Al(OH)3具有漂白性 | |
| C. | 含1molKOH的溶液与1molCO2完全反应后,溶液中c(K+)=c(HCO3-) | |
| D. | 在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-) |
14. 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解
(1)卤族元素位于周期表的p区,溴的价电子排布式为4s24p5
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在,使分子缔合的作用力是氢键
(3)根据表中提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是I
(4)已知高碘酸有两种形式,化学式分别为H5IO6 ( )和HIO4,前者为五元酸,后者为一元酸,请比较二者酸性强弱:H5IO6<HIO4(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸,请比较二者酸性强弱:H5IO6<HIO4(填“>”、“<”或“=”)
(5)已知ClO2为角型结构,中心氯原子周围有四对价层电子,ClO2-中心氯原子的杂化轨道类型为sp3
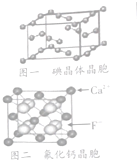
(6)图一为碘晶体晶胞结构,有关说法中正确的是AD(填答案选项的序号)
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以配位数4交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.硫晶体为无线延伸的空间结构,是原子晶体
D.碘晶体中微粒间存在非极性键和范德华力
(7)已知CaF2晶胞如图二所示,晶体的密度为pg/cm3,NA为阿伏伽德罗常数,相邻最近的两个Ca2+的核间距为acm,则CaF2的相对分子质量可以表示为$\frac{{a}^{3}ρ{N}_{A}}{4}$.
 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解(1)卤族元素位于周期表的p区,溴的价电子排布式为4s24p5
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在,使分子缔合的作用力是氢键
(3)根据表中提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是I
| 氯 | 氧 | 溴 | 碘 | 镀 | |
| 第一电离能(kj/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
 )和HIO4,前者为五元酸,后者为一元酸,请比较二者酸性强弱:H5IO6<HIO4(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸,请比较二者酸性强弱:H5IO6<HIO4(填“>”、“<”或“=”)(5)已知ClO2为角型结构,中心氯原子周围有四对价层电子,ClO2-中心氯原子的杂化轨道类型为sp3
(6)图一为碘晶体晶胞结构,有关说法中正确的是AD(填答案选项的序号)
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以配位数4交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.硫晶体为无线延伸的空间结构,是原子晶体
D.碘晶体中微粒间存在非极性键和范德华力
(7)已知CaF2晶胞如图二所示,晶体的密度为pg/cm3,NA为阿伏伽德罗常数,相邻最近的两个Ca2+的核间距为acm,则CaF2的相对分子质量可以表示为$\frac{{a}^{3}ρ{N}_{A}}{4}$.
 ;氧原子核外电子云有4 种不同的伸展方向,其最外层有6 种不同运动状态的电子.NaH2PO2中涉及到四种元素,它们的原子半径由小到大的顺序为H<O<P<Na.
;氧原子核外电子云有4 种不同的伸展方向,其最外层有6 种不同运动状态的电子.NaH2PO2中涉及到四种元素,它们的原子半径由小到大的顺序为H<O<P<Na.