题目内容
9.已知:某温度时,KW=1.0×10-12.在该温度下,测得0.1mol•L-1Na2A溶液pH=6,则下列说法正确的是( )| A. | H2A在水溶液中的电离方程式为:H2A=H++HA-,HA-?H++A2- | |
| B. | 常温下,NH4HA溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(A2-) | |
| C. | 相同条件下,体积相等、pH相等的盐酸与H2A溶液中和NaOH的量相等 | |
| D. | 0.0l mol•L-l的NaHA溶液pH>2 |
分析 某温度时,KW=1.0×10-12,则该温度下水中c(H+)=$\sqrt{Kw}$=1.0×10-6mol/L,pH=6,在该温度下,测得0.1mol•L-1Na2A溶液pH=6,溶液呈中性,说明Na2A是强酸强碱盐,则H2A是强酸,据此分析解答.
解答 解:A、KW=1.0×10-12,则该温度下水中c(H+)=$\sqrt{Kw}$=1.0×10-6mol/L,pH=6,溶液为中性,可知H2A是强酸,其电离方程式为H2A=2H++A2-,故A错误;
B、NH4HA为强酸酸式盐,氢离子的存在导致溶液呈酸性,加入NaOH使溶液显中性,则氢离子浓度等于氢氧根离子浓度,据电荷守恒可知c(Na+)+c(NH4+)=2c(A2-),故B错误;
C、H2A和盐酸都是强酸,其氢离子已经完全电离出来,所以体积相等、pH相等的盐酸与H2A溶液中和NaOH的量相等,故C正确;
D、0.0lmol•L-l的NaHA溶液中c(H+)=0.01mol/L,所以pH=2,故D错误;
故选C.
点评 本题考查弱电解质电离,正确判断酸的强弱是解本题关键,再结合物质之间的反应分析解答,同时考查学生灵活运用知识解答问题能力,题目难度中等.

练习册系列答案
相关题目
19.常温下,测得某溶液NaHX的pH>7,该溶液中有关浓度关系式正确的是( )
| A. | c(Na+)>c(H+)+c(X2-) | B. | c(Na+)=c(H2X)+c(HX-)+c(X2-) | ||
| C. | c(X2-)>c(H2X) | D. | c(Na+)+c(H+)=c(OH-)+c(HX-)+c(X2-) |
20.短周期元素X、Z、W、Q在元素周期表中的位置如图所示,其中X元素原子最外层电子数是最内层电子数的3倍,则下列说法正确的是( )
| X | Y | ||
| Z | W | Q |
| A. | X、W能与钠形成摩尔质量相同的化合物,且阴阳离子数比为1:2 | |
| B. | 含X和Z元素的常见化合物为分子晶体 | |
| C. | 氧化物对应的水化物酸性:W<Q | |
| D. | 原子半径大小关系:Q>W>Z>Y |
17.下列说法正确的是( )
| A. | 将三氯化铁溶液蒸干,可制得无水三氯化铁 | |
| B. | 明矾能水解生成Al(OH)3胶体,可用作净水剂,说明Al(OH)3具有漂白性 | |
| C. | 含1molKOH的溶液与1molCO2完全反应后,溶液中c(K+)=c(HCO3-) | |
| D. | 在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-) |
4.某溶液X中可能含有NO3-、Cl-、SO42-、CO32-、NH4+、Fe2+、Fe3+、Al3+和K+中的几种,且所含阴离子的物质的量相等.为确定该溶液X的成分,某学习小组做了如下实验:

则下列说法正确的是( )

则下列说法正确的是( )
| A. | 若含有Fe3+,则一定含有Cl- | |
| B. | SO42-、NH4+一定存在,NO3-、Cl-可能不存在 | |
| C. | CO32-、Al3+、K+一定不存在 | |
| D. | 气体甲、沉淀甲一定为纯净物 |
14.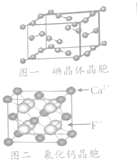 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解
(1)卤族元素位于周期表的p区,溴的价电子排布式为4s24p5
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在,使分子缔合的作用力是氢键
(3)根据表中提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是I
(4)已知高碘酸有两种形式,化学式分别为H5IO6 ( )和HIO4,前者为五元酸,后者为一元酸,请比较二者酸性强弱:H5IO6<HIO4(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸,请比较二者酸性强弱:H5IO6<HIO4(填“>”、“<”或“=”)
(5)已知ClO2为角型结构,中心氯原子周围有四对价层电子,ClO2-中心氯原子的杂化轨道类型为sp3
(6)图一为碘晶体晶胞结构,有关说法中正确的是AD(填答案选项的序号)
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以配位数4交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.硫晶体为无线延伸的空间结构,是原子晶体
D.碘晶体中微粒间存在非极性键和范德华力
(7)已知CaF2晶胞如图二所示,晶体的密度为pg/cm3,NA为阿伏伽德罗常数,相邻最近的两个Ca2+的核间距为acm,则CaF2的相对分子质量可以表示为$\frac{{a}^{3}ρ{N}_{A}}{4}$.
 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解(1)卤族元素位于周期表的p区,溴的价电子排布式为4s24p5
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在,使分子缔合的作用力是氢键
(3)根据表中提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是I
| 氯 | 氧 | 溴 | 碘 | 镀 | |
| 第一电离能(kj/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
 )和HIO4,前者为五元酸,后者为一元酸,请比较二者酸性强弱:H5IO6<HIO4(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸,请比较二者酸性强弱:H5IO6<HIO4(填“>”、“<”或“=”)(5)已知ClO2为角型结构,中心氯原子周围有四对价层电子,ClO2-中心氯原子的杂化轨道类型为sp3
(6)图一为碘晶体晶胞结构,有关说法中正确的是AD(填答案选项的序号)
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以配位数4交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.硫晶体为无线延伸的空间结构,是原子晶体
D.碘晶体中微粒间存在非极性键和范德华力
(7)已知CaF2晶胞如图二所示,晶体的密度为pg/cm3,NA为阿伏伽德罗常数,相邻最近的两个Ca2+的核间距为acm,则CaF2的相对分子质量可以表示为$\frac{{a}^{3}ρ{N}_{A}}{4}$.
18.分子式为C6H12O2的有机物X,在稀硫酸存在下水解可得到一种相对分子质量为46的有机物,则符合此条件的有机物X最多有( )
| A. | 12种 | B. | 10种 | C. | 8种 | D. | 7种 |