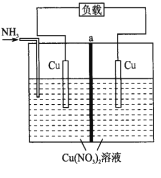
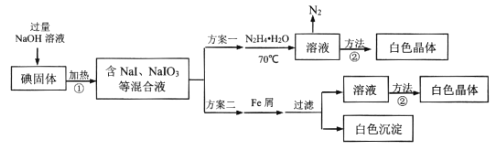
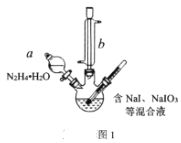
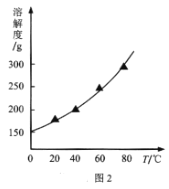
题目内容
【题目】过氧化钠是一种淡黄色固体,它能与二氧化碳反应生成氧气,在潜水艇中用作制氧剂,供人类呼吸之用,它与二氧化碳反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2。某学生为了验证这一实验,以足量的大理石、足量的盐酸和1.95克过氧化钠样品为原料,制取O2,设计出如下实验装置:
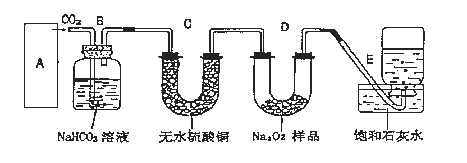
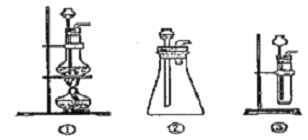
(1)A中制取CO2 的装置,应从下列图①、②、③中选哪个图:___。
B装置的作用是___,C装置内可能出现的现象是___。为了检验E中收集到的气体,在取出集气瓶后,检验方法是___。
(2)若E中的石灰水出现出现轻微白色浑浊,请说明原因:___。(用离子反应方程式表示)。
(3)反应完毕时,若测得E中的集气瓶收集到的气体为260mL,当装置的气密性良好的情况下,实际收集到的氧气体积比理论计算值___(答大或小),相差___mL(取整数值,所用数据均在标准状况下测定),这是由于____。
(4)你认为上述A-E的实验装置中,E部分是否安全、合理?___(答是或否),理由是___。
【答案】②、③ 除去CO2中混有的HCl气体 变蓝 向集气瓶中伸入带火星的木条,复燃 Ca2++2OH-+CO2=CaCO3↓+H2O 小 20ml Na2O2没有反应完全 否 E装置没有防倒吸装置,容易引起倒吸
【解析】
(1)实验室用碳酸钙和稀盐酸反应制备二氧化碳,反应无需加热,且反应需要较多二氧化碳,应用图3装置制备;实验中要依次进行除杂、干燥收集等操作;
(2)二氧化碳和澄清石灰水反应生成碳酸钙白色沉淀;
(3)根据过氧化钠的质量可以生成氧气的体积,理论生成气体的体积-实际氧气的体积=差值;
(4)E装置没有防倒吸装置,容易引起倒吸。
(1)该反应的药品是固体和液体,且不需加热,所以所需装置为固液混合不加热型,所以排除图①;图②中能制取少量二氧化碳、图③能制取大量二氧化碳,所以选图②、图③;
大理石和盐酸的反应是放热反应,盐酸具有挥发性,所以制取的二氧化碳中含有氯化氢气体、水蒸气,氯化氢和碳酸氢钠能反应生成二氧化碳,所以B装置的作用是吸收A装置中产生的盐酸酸雾,除去CO2中混有的HCl气体;
二氧化碳和碳酸氢钠不反应,水蒸气能使无水硫酸铜由白色变蓝色,所以C装置内可能出现的现象是白色固体变蓝色;
过氧化钠和二氧化碳反应生成氧气,氧气能使带火星的木条复燃,检验时,可用带火星的木条放在管口,木条复燃说明收集到的气体为氧气;
(2)二氧化碳能使澄清的石灰水变浑浊,若E中石灰水出现轻微白色浑浊,说明未反应的二氧化碳与石灰水反应所致,发生反应Ca2++2OH-+CO2=CaCO3↓+H2O;
(3)1.95g过氧化钠完全反应生成氧气的体积为v.
2Na2O2----O2
2mol 22.4L
![]() V
V
V=0.28L=280mL>260mL,所以实际收集到的氧气体积比理论计算值小;
280mL-260mL=20mL;
原因是Na2O2没有反应完全,导致生成的氧气的体积偏小;
(4)E装置没有防倒吸装置,容易引起倒吸,所以不安全、不合理,所以需要改进。

【题目】将![]() 和
和![]() 以
以![]() (体积比)分别通入到体积为2L的恒容密闭容器中进行反应:
(体积比)分别通入到体积为2L的恒容密闭容器中进行反应:![]() ,得到如下三组数据,其中实验①、②没有使用催化剂。下列说法不正确的是( )
,得到如下三组数据,其中实验①、②没有使用催化剂。下列说法不正确的是( )
实验 | 温度/℃ | 起始 | 平衡 | 达平衡所需时间/min |
① | 500 | 5.00 | 2.00 | 40 |
② | 800 | 3.00 | 1.00 | 15 |
③ | 500 | 3.00 | 1.20 | 9 |
A. 实验①中,在![]() 内,以
内,以![]() 表示的反应速率大于
表示的反应速率大于![]()
B. 比较实验①和②,不能说明浓度对反应速率的影响
C. 比较实验①和②,不能说明反应速率随温度升高而增大
D. 比较实验②和③,说明实验③使用了催化剂