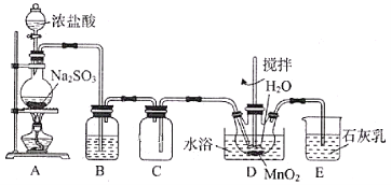
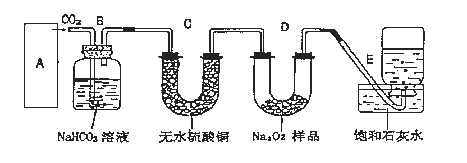
��Ŀ����
����Ŀ��Ԫ��A��B��D��E��F��G��Ϊ����������Ԫ�أ���ԭ��������������ֻ��EΪ����Ԫ�ء���֪Aԭ��ֻ��һ�����Ӳ㣻E��F��ԭ�������ֱ���B��D��2��������D��Fͬ���壬B��E��ͬ���塣�ش��������⣺
��1��Ԫ��D�����ڱ��е�λ��____��
��2��F��G�γɵĻ��������������ԭ�Ӿ�Ϊ8�����ȶ��ṹ���û�����ĵ���ʽΪ____��
��3��������Ԫ����ɵ������У�������Ҫ��д����ѧ����ʽ
���������ᷴӦ��������ǿ��______��
���û���Ӧ�����������ڳ��¾�Ϊ��̬____��
��4����D��F��G��ѡȡ2��Ԫ����ɾ���Ư�ס�ɱ�����õĻ�����___��
���𰸡��ڶ�����VI A�� ![]() ��
��![]()
![]()
 ClO2��SO2
ClO2��SO2
��������
AԪ��Ϊ����������Ԫ�أ���Aԭ��ֻ��һ�����Ӳ㣬����AΪ��Ԫ�أ�F��ԭ��������D��2������D��F��ͬһ���壬����DΪ��Ԫ�أ�FΪ��Ԫ�أ���GΪ��Ԫ�أ�EΪ����Ԫ�أ���ԭ��������B��2��������E���������Ϊż����λ�ڵ������ڣ�ΪþԪ�أ�����B��̼Ԫ�ء���A��B��D��E��F��G������H��C��O��Mg��S��ClԪ�ء�
(1)Ԫ��DΪ��Ԫ�أ�λ�ڵڶ�����VI A�壻
(2)FΪ��Ԫ�أ�GΪ��Ԫ�أ��γɵĻ��������������ԭ�Ӿ�����8�����ȶ��ṹ������Ӧ��2�ۣ�����1�ۣ����Ըû�����ΪSCl2��S2Cl2��������ͬ���壬Ҳ�����γ�����Ǽ��Թ��ۼ��������Ӧ�ĵ���ʽΪ![]() ��
��
(3)��������ǿ�ᣬͨ����������������ԭ��Ӧ������������Ԫ���У�����ǿ�����Ե������뵽�����ᣬ���ֻ�ԭ�Ե����뵽H2S��H2SO3�ȣ���������ֻ��H2SO3������ᷴӦ���ɵ�������ǿ�H2SO3+HClO=HCl+H2SO4��
���û���Ӧ��Ҫ�е��ʲ��룬�������Ϊ���壬�ų����ȡ���ȣ��뵽þ�Ͷ�����̼�� ��
��
(4)��ѧѧϰ�ľ���Ư���Ե����ʰ����������������ơ��������⡢�����ᡢ�������ȵȣ�������������Ԫ����ɵ������Ԫ��Ϊ2�ֵģ��뵽�˶������ȡ���������

 ��������ϵ�д�
��������ϵ�д� ��ӡ�Ļ���ʱ����ϵ�д�
��ӡ�Ļ���ʱ����ϵ�д� ��ѧ�����ϵ�д�
��ѧ�����ϵ�д�����Ŀ�����͵��Ļ������ڹ�ũҵ�����������������ж��м���㷺����;����ش������뵪Ԫ���йص����⣺
��1���������ȣ��ṹʽΪCl-N=O�����л��ϳ��е���Ҫ�Լ�������Cl2��NO��ͨ�������·�Ӧ�Ƶã���Ӧ����ʽΪ![]() ��
��
��֪���ֻ�ѧ���ļ������������ʾ��
��ѧ�� |
|
|
|
|
���ܣ� | 243 | a | 607 | 630 |
��Cl2��NO��Ӧ����ClNO�Ĺ�����ת����4mol���ӣ������Ϸų�������Ϊ___kJ���������ֺ���ĸ��ʾ��
��2���¶�һ��ʱ����һ�����Ϊ1L���ܱ�������ͨ��2mol NO��1mol Cl2��10minʱClNO���ռ���������40%����Ӧ��ʼ��10min��NO��ƽ����Ӧ���ʣ�![]() =___
=___![]() ��
��
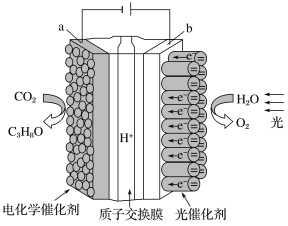
��3�����õ绯ѧԭ������NO2��O2������KNO3�Ƴ�ȼ�ϵ�أ�װ����ͼ��ʾ��
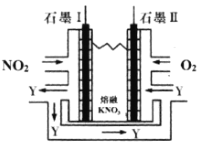
��ع���ʱ��NO2ת�����ɫ������Y��N2O5������ѭ��ʹ�ã���ʯī��Ϊ��Դ____����ʯī�����������ĵ缫��ӦʽΪ___��
��4��������ˮ����ˮ�����ɸ�Ӫ��������ʹ�ô�����ȥ����������NH4+��ʾ���������������ʡ�������������ȥ���������ӷ�Ӧ����ʽ��____��