题目内容
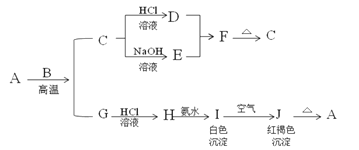
【题目】工业制溴的大致流程如图:

已知溴的沸点为58.7℃,常温下在水中的溶解度为3.58g;溴与碳酸钠溶液反应生成NaBr、NaBrO3、CO2等。则下列理解不正确的是( )
A. 步骤②通热空气是利用了溴的挥发性
B. 从混合液甲到混合液乙,目的是对溴进行富集
C. 步骤④加硫酸后发生氧化还原反应,其中氧化产物与还原产物的物质的量之比为1:1
D. 操作⑤可以采取萃取、分液、蒸馏
【答案】C
【解析】
A.溴单质易挥发,通入热空气对溶液进行加热,利于溴蒸气逸出,A项正确;
B.因母液中含溴量较少,所以先用热空气将溴单质吹出,先用碳酸钠溶液吸收,再用硫酸酸化而重新生成溴单质,完成了溴的富集,B项正确;
C.步骤④加硫酸酸化,发生反应:5NaBr+NaBrO3+3H2SO4=3Na2SO4+3Br2+3H2O,氧化产物和还原产物均为溴单质,其物质的量之比为5:1,C项错误;
D.操作⑤应是从含溴的水溶液中获得溴单质,通常可加入有机萃取剂进行萃取、分液、蒸馏,以获得单质溴,D项正确;
所以答案选择C项。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
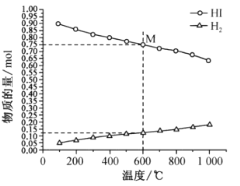
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是:
A. 反应达到平衡时,X的转化率为50% B. 反应可表示为X+3Y![]() 2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数