题目内容
【题目】碘化钠在有机合成中用途广泛,工业制备碘化钠有多种方法,下图是制备碘化钠的两种方案。已知:3I2+6NaOH=5NaI+NaIO3+3H2O;N2H4·H2O的沸点118℃,100℃开始分解。
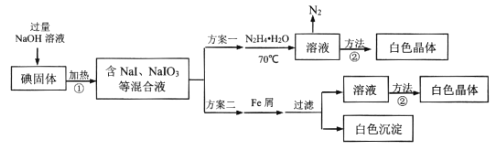
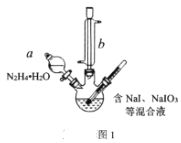
(1)方案一中加入N2H4·H2O后发生的离子反应为:2IO3-(aq)+3N2H4·H2O(l)=2I-(aq)+3N2(g)+7H2O(l) △H<0;部分装置如图1所示。
①图1中仪器b的名称为___。若要使分液漏斗中的液体流入三颈烧瓶中,具体的操作是___。
②实验过程中需控制反应温度70℃左右的原因是___。图1中加热的方式最好选用____。
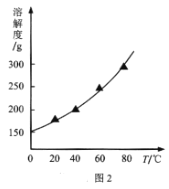
(2)结合NaI溶解度曲线(如图2),流程图中方法②的具体操作为:加热蒸发、___、过滤、洗涤得到白色晶体。
(3)写出方案二中加入Fe屑后的离子方程式_____。
(4)方案二比方案一得到产品的产率略低,其原因是____。
【答案】冷凝管 先打开分液漏斗的玻璃塞,再缓慢旋开活塞 温度过高,N2H4·H2O分解及挥发,温度过低反应太慢 水浴加热 冷却结晶 3H2O+3Fe+IO3-=3Fe(OH)2↓+I- 沉淀未洗涤
【解析】
(1)为了使分液漏斗中液体顺利流下,要先打开分液漏斗的玻璃塞,平衡气压;控制温度既要考虑温高造成的影响,也要考虑温低造成的影响;
(2)溶解度曲线的重要用途之一就是用来判断是否可以采用降温结晶法;
(3)“左顾右盼”判断出部分的反应物和生成物;
(4)对比两个方案流程的差异,流程二进行了晶体的洗涤,因NaI易溶于水,会造成部分NaI溶解损耗。
(1)①仪器b的名称是(直形)冷凝管;若要使分液漏斗中的液体流入三颈烧瓶,具体的操作是:先打开分液漏斗的玻璃塞,再缓慢地旋开活塞;先打开玻璃塞,是为了平衡气压,便于液体顺利流下;
②实验过程中需控制反应温度在70℃左右,原因是温度过高N2H4·H2O分解及挥发加剧,温度过低则反应太慢;图I中加热方式最好选用水浴加热;
(2)NaI的溶解度曲线表明:NaI的溶解度随着温度的升高显著增大。流程图中方法②是从溶液中获得NaI晶体,首先是通过加热蒸发浓缩,将NaI溶液由不饱和溶液变为(过)饱和溶液,然后降温(冷却)结晶,然后过滤、洗涤、干燥即可;
(3)含NaI、NaIO3、NaOH等的混合液,加入铁屑后,IO3-被反应掉,生成了I-,从生成白色沉淀知道铁反应后生成了Fe(OH)2,反应的离子方程式为:3Fe+IO3-+3H2O=3Fe(OH)2↓+I-;
(4)方案二比方案一得到的产品的产率略低,是因为方案一从溶液中直接得到了沉淀,未经洗涤,而方案二在题给的方法②描述中明确提到了洗涤。