题目内容
【题目】(1)少量铁粉与100 mL 0.01 mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的______。(填序号)
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加CH3COONa固体 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10 mL 0.1 mol/L盐酸
(2)下列可以证明H2(g)+I2(g) ![]() 2HI(g)已达平衡状态的是______。(填序号)
2HI(g)已达平衡状态的是______。(填序号)
①单位时间内生成n mol H2的同时,生成n mol HI
②一个H—H键断裂的同时有两个H—I键断裂
③百分含量w(HI)=w(I2) ④反应速率v(H2)=v(I2)=v(HI)
⑤c(HI)∶c(H2)∶c(I2)=2∶1∶1
⑥温度和体积一定时,生成物浓度不再变化
⑦温度和体积一定时,容器内压强不再变化
⑧温度和体积一定时,容器内气体颜色不再变化
⑨条件一定,混合气体的平均相对分子质量不再变化
(3)已知下列反应的平衡常数:①H2(g)+S(s) ![]() H2S(g),K1;
H2S(g),K1;
②S(s)+O2(g) ![]() SO2(g),K2;则反应H2(g)+SO2(g)
SO2(g),K2;则反应H2(g)+SO2(g) ![]() O2(g)+H2S(g)的平衡常数是______。(用K1,K2 的代数式表示)
O2(g)+H2S(g)的平衡常数是______。(用K1,K2 的代数式表示)
(4)已知:①2C(s)+O2(g)===2CO(g) ΔH=-221.0 kJ/mol
②2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ/mol
则制备水煤气的反应C(s)+H2O(g)===CO(g)+H2(g)的ΔH为______。
【答案】③⑦⑧ ②⑥⑧ ![]() +131.3kJ/mol
+131.3kJ/mol
【解析】
(1)为了加快此反应速率而不改变H2的产量,少量铁粉完全反应,则可增大氢离子浓度、构成原电池、升高温度等来加快反应速率;
①加H2O,氢离子浓度减小,反应速率减慢,故错误;
②加NaOH固体,氢离子浓度减小,反应速率减慢,故错误;
③滴入几滴浓盐酸,氢离子浓度增大,反应速率加快,故正确;
④加CH3COONa固体,生成醋酸,氢离子浓度减小,反应速率减慢,故错误;
⑤加NaCl溶液,氢离子浓度减小,反应速率减慢,故错误;
⑥滴入几滴硫酸铜溶液,构成原电池,反应速率加快,但Fe少量,导致生成的氢气减少,故错误;
⑦升高温度(不考虑盐酸挥发),反应速率加快,故正确;
⑧改用10mL0.1mol/L盐酸,氢离子浓度增大,反应速率加快,故正确;
答案为:③⑦⑧
(2)当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
①单位时间内生成nmolH2的同时生成2nmolHI,才是平衡状态,故错误;
②一个HH键断裂等效于生成两个HI同时有两个HI键断裂,正逆反应速率相等,达平衡状态,故正确;
③百分含量不变,而不是w(HI)=w(I2),故错误;
④只要反应发生就有反应速率v(H2)=v(I2)=![]() v(HI),故错误;
v(HI),故错误;
⑤当体系达平衡状态时,c(HI):c(H2):c(I2)可能为2:1:1,也可能不是2:1:1,与各物质的初始浓度及转化率有关,故错误;
⑥温度和体积一定时,生成物浓度不再变化,正逆反应速率相等,达平衡状态,故正确;
⑦温度和体积一定时,两边气体计量数相等,容器内的压强始终不再变化,故错误;
⑧温度和体积一定时,混合气体颜色不再变化,正逆反应速率相等,达平衡状态,故正确;
⑨条件一定时,两边气体计量数相等,混合气体的平均相对分子质量始终不再变化,故错误;
答案为:②⑥⑧
(3)H2+SH2S反应中,S为固体,所以K1=![]() ;S+O2SO2,S为固体,K2=
;S+O2SO2,S为固体,K2=![]() ;H2+SO2O2+H2S的平衡常数为:
;H2+SO2O2+H2S的平衡常数为: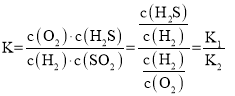
答案为:![]()
(4)①2C(s)+O2(g)═2CO(g);△H=-221.0 kJ/mol,
②2H2(g)+O2(g)═2H2O;△H=-483.6 kJ/mol,依据盖斯定律,![]() 得到 C(s)+H2O(g)═CO(g)+H2(g)△H=+131.3 kJ/mol;
得到 C(s)+H2O(g)═CO(g)+H2(g)△H=+131.3 kJ/mol;
故答案为:+131.3 kJmol-1。

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是:
A. 反应达到平衡时,X的转化率为50% B. 反应可表示为X+3Y![]() 2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数