题目内容
【题目】某热再生电池工作原理如下图所示。通入![]() 时电池开始工作,左边电极棒不断溶解,右边电极棒不断增厚,中间a为离子交换膜,放电后可通过废热进行充电。已知电池总反应:
时电池开始工作,左边电极棒不断溶解,右边电极棒不断增厚,中间a为离子交换膜,放电后可通过废热进行充电。已知电池总反应:![]() 。下列说法不正确的是( )
。下列说法不正确的是( )
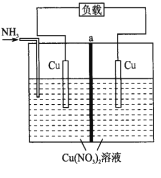
A. 此电池为二次电池
B. 放电时,左边电极发生氧化反应
C. a为阳离子交换膜
D. 放电时,转移![]() 电子,两电极质量变化的差值为
电子,两电极质量变化的差值为![]()
【答案】C
【解析】
A.题目中已明确告知该电池可通过废热进行充电,所以该电池为二次电池,A项正确;
B.放电时,左侧的铜电极棒不断溶解,发生氧化反应:Cu-2e-=Cu2+,B项正确;
C.在原电池内电路中阳离子向正极移动,如a为阳离子交换膜,电极溶解生成的铜离子要向右侧移动,通入NH3要消耗Cu2+,显然左侧阳离子不断减小,明显不利于电池反应正常进行,C项错误;
D.放电时,负极和正极的反应分别为:Cu-2e-=Cu2+、Cu2++2e-=Cu,转移0.2mol电子,负极减重0.1mol Cu,正极增重0.1mol Cu,两极质量变化的差值为0.2mol×64g·mol-1=12.8g,D项正确;
所以答案选择C项。

练习册系列答案
相关题目