题目内容
2.用下列有关实验装置进行相应实验,能达到实验目的是( )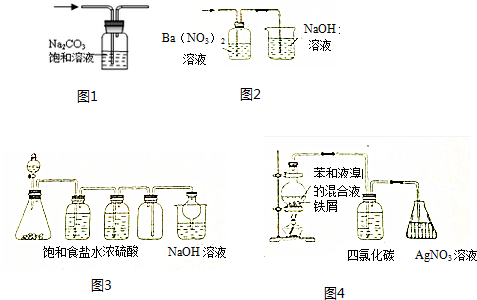
| A. | 用图1装置出去CO2中混有的HCl气体 | |
| B. | 用图2装置除去SO2中混有的SO3气体 | |
| C. | 用图3装置可以制备并收集Cl2 | |
| D. | 用图4装置证明苯与液溴能发生取代反应 |
分析 A.二氧化碳能与碳酸钠反应;
B.氢离子和硝酸根相当于硝酸;
C.浓盐酸和二氧化锰反应需要加热;
D.液溴与苯发生的反应是取代反应的话,会有小分子HBr气体产生,用硝酸银溶液来检验溴离子的存在.
解答 解:A.二氧化碳和氯化氢都能与碳酸钠反应,将原物质除掉,故A错误;
B.氢离子和硝酸根相当于硝酸,有强氧化性,能将二氧化硫氧化为硫酸,故B错误;
C.浓盐酸和二氧化锰反应需要加热,不加热不反应,故C错误;
D.液溴与苯发生的反应是取代反应的话,会有小分子HBr气体产生,用硝酸银溶液来检验溴离子的存在,如产生白色沉淀则证明为取代反应;液溴具有挥发性,选用CCl4除去可能会发出来的溴蒸汽,故D正确.
故选D.
点评 本题考查了化学实验方案评价,涉及气体的制备、收集、除杂等知识点,根据气体的溶解性和密度确定收集方法,题目难度不大.

练习册系列答案
相关题目
13.如图所示的装置中,能够组成原电池,产生电流的是( )
| A. |  | B. | 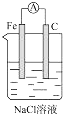 | C. |  | D. | 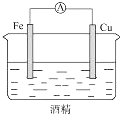 |
10.室温下,稀氨水中存在电离平衡NH3•H2O?NH4++OH-,有关叙述正确的是( )
| A. | 加入氯化铵固体,溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$减小 | |
| B. | 加水不断稀释,溶液碱性一定增强 | |
| C. | 加水稀释,平衡常数Kb增大 | |
| D. | 加入NaOH固体,平衡逆向移动 |
2.向某溶液中加入含Fe2+的溶液后,无明显变化.当再滴入几滴新制氯水后,混合溶液变成红色,则下列结论错误的是( )
| A. | 该溶液中一定含有SCN- | B. | 氧化性:Fe2+>Cl2 | ||
| C. | Fe2+与SCN-不能形成红色物质 | D. | Fe2+被氧化为Fe3+ |
 物质的结构决定性质,性质反映其结构特点.
物质的结构决定性质,性质反映其结构特点.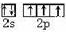 .
.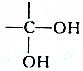 结构的有机物不能稳定存在,根据以上信息,试回答:
结构的有机物不能稳定存在,根据以上信息,试回答: +2H2O,是酯化反应.
+2H2O,是酯化反应.
