题目内容
1.若用90g 碳酸锰矿(主要成分为MnCO3、MnO2、FeCO3、MgO、SiO2、Al2O3和杂质,其中杂质不参与反应)进行如图1操作,已知MnCO3难溶于水,一种新型、环保的运用阴离子膜的电解新技术,可用于从碳酸锰矿中提取金属锰,
(1)已知浸出液中含有Fe2+、Fe3+、Mn2+,则试剂a可能是C(填字母).试剂b与浸出液反应时不应引入新的杂质,则试剂b的名称为过氧化氢.
A.HClO B.HCl C.H2SO4 D.HNO3
(2)在浸出液中锰元素只以Mn2+的形式存在,在滤渣中也无MnO2,请解释原因:MnO2在酸性条件下被Fe2+还原为Mn2+.
(3)已知不同金属生成氢氧化物沉淀所需的pH值如图2.通NH3时调节溶液的pH=7,则滤渣的成分是Fe(OH)3、Al(OH)3;此时溶液中含有的阳离子为H+、NH4+、Mg2+、Mn2+.
(4)如图3装置内箭头表示阴离子移动方向,则B极为正极,实际阳极以试剂a为电解液,该技术之所以采用阴离子交换膜,是因为防止Mn2+进入阳极发生副反应生成MnO2,造成资源浪费.
(5)已知酒精的汽化热是n kJ/mol.反应:
2CO2(g)+6H2(g)→C2H5OH(g)+3H2O(l)△H=-p kJ/mol
C2H5OH(l)+3O2(g)→2CO2(g)+3H2O(l)△H=-qkJ/mol
据此写出电解时两气孔逸出气体反应的热化学方程式:2H2(g)+O2(g)=2H2O(l)△H=-$\frac{p+q+n}{3}$ kJ/mol
(6)已知某种物质X(相对分子质量209),其最高价氧化物对应水化物类似于硝酸,且能将Mn2+完全氧化为MnO4-,而自身还原为+3价,若将制得的金属锰,先用过量硫酸氧化为Mn2+,则Mn2+与HXO3反应的离子方程是为2Mn2++5XO3-+14H+=2MnO4-+5X3++7H2O.
(7)若上述反应进行完全,并测得X3+的质量为283.15g,碳酸锰矿与实际a反应,生成的气体体积为13.44L(标况下测得),则碳酸锰在原矿中的质量分数是69.00%.

分析 用90g 碳酸锰矿(主要成分为MnCO3、MnO2、FeCO3、MgO、SiO2、Al2O3和杂质,其中杂质不参与反应)加入过量试剂a为硫酸,加入试剂b是氧化亚铁离子为铁离子,浸出液中二氧化锰被还原为锰离子,通NH3时调节溶液的pH=7沉淀铁离子和铝离子,过滤得到滤液主要为镁离子、锰离子、氢离子和铵根离子,进一步精制除去铵根离子和镁离子,得到阴极电解液,得到金属锰;
(1)碳酸锰矿(主要成分为MnCO3、MnO2、FeCO3、MgO、SiO2、Al2O3和杂质,其中杂质不参与反应),盐酸中氯离子易被氧化剂氧化,所以选择硫酸酸溶,已知浸出液中含有Fe2+、Fe3+、Mn2+、Al3+,加入试剂b是氧化亚铁离子为铁离子,便于调节溶液PH除去;
(2)已知浸出液中含有Fe2+、Fe3+、Mn2+,亚铁离子具有还原性,二氧化锰酸性条件下具有氧化性;
(3)通NH3时调节溶液的pH=7,铝离子和铁离子全部沉淀,锰离子、镁离子不沉淀;
(4)阴离子移向电解池的阳极,A为负极,B为正极,阴离子交换膜防止阳离子通过;
(5)电解时两气孔逸出气体为氢气和氧气,结合热化学方程式和盖斯定律计算得到氢气燃烧生成液态水的热化学方程式;
(6)已知某种物质X(相对分子质量209),其最高价氧化物对应水化物类似于硝酸,且能将Mn2+完全氧化为MnO4-,而自身还原为+3价,若将制得的金属锰,先用过量硫酸氧化为Mn2+,则Mn2+与HXO3反应的离子方程依据电子守恒、原子守恒配平得到;
(7)若上述反应进行完全,并测得X3+的质量为283.15g,物质的量=$\frac{283.15g}{209g/mol}$=1.35mol,碳酸锰矿与试剂a反应,生成的气体体积为13.44L(标况下测得),气体为二氧化碳物质的量=$\frac{13.44L}{22.4L/mol}$=0.6mol,锰元素守恒,结合化学方程式计算得到,2Mn2++5XO3-+14H+=2MnO4-+5X3++7H2O
MnCO3物质的量为1.35mol×$\frac{2}{5}$=0.54mol,计算得到碳酸锰在原矿中的质量分数.
解答 解:用90g 碳酸锰矿(主要成分为MnCO3、MnO2、FeCO3、MgO、SiO2、Al2O3和杂质,其中杂质不参与反应)加入过量试剂a为硫酸,加入试剂b是氧化亚铁离子为铁离子,浸出液中二氧化锰被还原为锰离子,通NH3时调节溶液的pH=7沉淀铁离子和铝离子,过滤得到滤液主要为镁离子、锰离子、氢离子和铵根离子,进一步精制除去铵根离子和镁离子,得到阴极电解液,得到金属锰;
(1)碳酸锰矿(主要成分为MnCO3、MnO2、FeCO3、MgO、SiO2、Al2O3和杂质,其中杂质不参与反应),盐酸中氯离子易被氧化剂氧化,所以选择硫酸酸溶,试剂a为硫酸;已知浸出液中含有Fe2+、Fe3+、Mn2+、Al3+,加入试剂b是氧化亚铁离子为铁离子,便于调节溶液PH除去,试剂b为过氧化氢(双氧水),
故答案为:C;过氧化氢(双氧水);
(2)二氧化锰酸性条件下具有氧化性,和亚铁离子酸性条件发生氧化还原反应,二氧化锰被还原为锰离子,
故答案为:MnO2在酸性条件下被Fe2+还原为Mn2+;
(3)通过图象分析通NH3时调节溶液的pH=7,铝离子和铁离子全部沉淀,锰离子、镁离子不沉淀,则滤渣的成分是Fe(OH)3、Al(OH)3,此时溶液中含有的阳离子H+、NH4+、Mg2+、Mn2+,
故答案为:Fe(OH)3、Al(OH)3;H+、NH4+、Mg2+、Mn2+;
(4)图3装置内箭头表示阴离子移动方向,电解池电解原理可知,阴离子移向阳极,则B极为正极,采用阴离子交换膜防止Mn2+进入阳极发生副反应生成MnO2,造成资源浪费,
故答案为:正;防止Mn2+进入阳极发生副反应生成MnO2,造成资源浪费;
(5)已知酒精的汽化热是n kJ/mol,
①C2H5OH(l)=C2H5OH(g)△H=nkJ/mol
②2CO2(g)+6H2(g)→C2H5OH(g)+3H2O(l)△H=-p kJ/mol
③C2H5OH(l)+3O2(g)→2CO2(g)+3H2O(l)△H=-qkJ/mol
电解时两气孔逸出气体反应为氢气和氧气发生的反应,依据盖斯定律计算(②+③-①)×$\frac{1}{3}$得到的热化学方程式为:
2H2(g)+O2(g)=2H2O(l)△H=-$\frac{p+q+n}{3}$ kJ/mol,
故答案为:2H2(g)+O2(g)=2H2O(l)△H=-$\frac{p+q+n}{3}$ kJ/mol;
(6)已知某种物质X(相对分子质量209),其最高价氧化物对应水化物类似于硝酸,则为HXO3,X化合价为+5价,且能将Mn2+完全氧化为MnO4-,而自身还原为+3价,结合电子守恒、原子守恒、电荷守恒配平离子方程式为:2Mn2++5XO3-+14H+=2MnO4-+5X3++7H2O,
故答案为:2Mn2++5XO3-+14H+=2MnO4-+5X3++7H2O;
(7)若上述反应进行完全,并测得X3+的质量为283.15g,物质的量=$\frac{283.15g}{209g/mol}$=1.35mol,碳酸锰矿与试剂a反应,生成的气体体积为13.44L(标况下测得),气体为二氧化碳物质的量=$\frac{13.44L}{22.4L/mol}$=0.6mol,锰元素守恒,结合化学方程式计算得到,2Mn2++5XO3-+14H+=2MnO4-+5X3++7H2O
锰元素物质的量全部看为MnCO3物质的量,化学方程式计算为1.35mol×$\frac{2}{5}$=0.54mol,计算得到碳酸锰在原矿中的质量分数=$\frac{0.54mol×115g/mol}{90g}$×100%=69.00%,
故答案为:69.00%.
点评 本题考查了混合物质的分离提纯,热化学方程式书写,化学方程式计算应用,掌握基础是关键,题目难度较大.

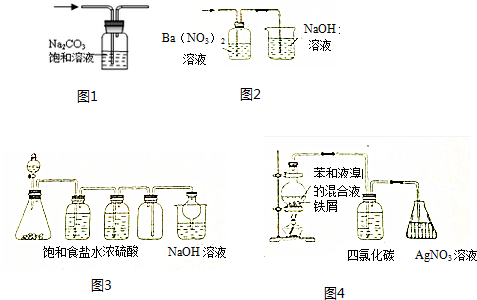
| A. | 用图1装置出去CO2中混有的HCl气体 | |
| B. | 用图2装置除去SO2中混有的SO3气体 | |
| C. | 用图3装置可以制备并收集Cl2 | |
| D. | 用图4装置证明苯与液溴能发生取代反应 |
 将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘少.下列说法正确的是( )
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘少.下列说法正确的是( )| A. | 液滴中的Cl-由a区向b区迁移 | |
| B. | 液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-═4OH- | |
| C. | 液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH-形成Fe(OH)2,进一步氧化、脱水形成铁锈 | |
| D. | 若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e-═Cu2+ |
| A. | 以石墨作电极电解氯化镁溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| B. | 澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | 氯气通入蒸馏水中 Cl2+H2O═Cl-+ClO-+2 H+ | |
| D. | 次氯酸钠溶液中通入SO2气体:2ClO-+SO2+H2O═2HClO+SO32- |
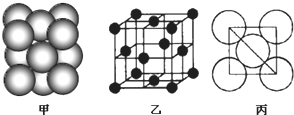
| A. | 水分子的电子式为 | |
| B. | Ca2+基态电子排布式为1s22s22p63s23p6 | |
| C. | 基态氟原子排布图为 | |
| D. | 钾的原子结构示意图为 |
| A. | 由:H++OH-→H2O+57.3KJ,可知:含0.5mol H2SO4的浓溶液与含1molNaOH的溶液混合,放热量大于57.5KJ | |
| B. | 从C(石墨)→C(金刚石)-119KJ,可知:金刚石比石墨更稳定 | |
| C. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 | |
| D. | 2gH2完全燃烧生成液态水放出285.8KJ热量,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)→2H2O(1)+285.8KJ |

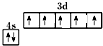 ,与D同周期的所有元素的基态原子中最外层电子数与D原子相同的元素有8种.
,与D同周期的所有元素的基态原子中最外层电子数与D原子相同的元素有8种.