题目内容
7.一块表面已部分氧化的钠的质量是1.08g,将其放入10g水中后,得到氢气224mL(标准状况下).求:(1)金属钠表面生成氧化钠的物质的量是多少?
(2)所得溶液里溶质的质量分数是多少?
分析 (1)根据n=$\frac{V}{{V}_{m}}$计算氢气的物质的量,再根据反应2Na+2H2O=2NaOH+H2↑计算样品中Na的质量,进而计算Na2O的质量,根据Na2O中元素质量分数计算含有Na的质量,然后求氧化钠的物质的量;
(2)所得溶液里溶质是氢氧化钠,根据钠守恒求氢氧化钠的物质的量,然后根据m=nM,求氢氧化钠的质量,溶质的质量分数是$\frac{氢氧化钠的质量}{1.08g+10g-0.01×2g}×100%$.
解答 解:(1)n(H2)=$\frac{0.224L}{22.4L/mol}$=0.01mol,
2Na+2H2O=2NaOH+H2↑
46g 1mol
m(Na) 0.01mol
m(Na)=$\frac{46g×0.01mol}{1mol}$=0.46g,
故m(Na2O)=1.08g-0.46g=0.62g,Na2O的物质的量为:$\frac{0.62g}{62g/mol}$=0.01mol,
答:金属钠表面生成氧化钠的物质的量是0.01mol;
(2)n(NaOH)=n(Na)+2(Na2O)=$\frac{0.46}{23}mol$+2×0.01mol=0.04mol,所以溶质的质量分数是$\frac{氢氧化钠的质量}{1.08g+10g-0.01×2g}×100%$=$\frac{0.04×40}{11.06}$×100%=14.5%,
答:所得溶液里溶质的质量分数是14.5%.
点评 本题考查混合物的计算,题目难度不大,注意钠和氧化钠的性质,利用钠守恒法结合化学方程式计算.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17.下列各化合物的命名中正确的是( )
| A. |  2,4-二硝基甲苯 2,4-二硝基甲苯 | B. | (CH3CH2)2CHCH33-甲基戊烷 | ||
| C. |  1,3-二甲基-2-丁烯 1,3-二甲基-2-丁烯 | D. |  异戊烷 异戊烷 |
18.在一密闭容器中充入一定量的H2和N2,经测定反应开始后3s内的v(H2)=0.3mol•L-1•s-1,则3s末NH3的浓度为( )
| A. | 0.45 mol•L-1 | B. | 0.6 mol•L-1 | C. | 0.9 mol•L-1 | D. | 1.2 mol•L-1 |
2.用下列有关实验装置进行相应实验,能达到实验目的是( )
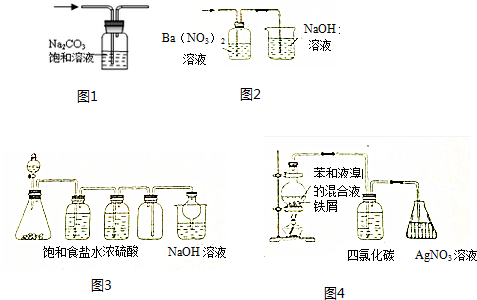

| A. | 用图1装置出去CO2中混有的HCl气体 | |
| B. | 用图2装置除去SO2中混有的SO3气体 | |
| C. | 用图3装置可以制备并收集Cl2 | |
| D. | 用图4装置证明苯与液溴能发生取代反应 |
12.下列说法正确的是( )
| A. | 电离时能生成H+的化合物一定是酸 | |
| B. | 碱在电离时一定有OH-生成 | |
| C. | 因为硫酸由H+和SO42-构成,故电离时能生成H+和SO42- | |
| D. | 氢氧化钠在水溶液中和熔化时都能发生电离 |
6. 将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘少.下列说法正确的是( )
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘少.下列说法正确的是( )
 将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘少.下列说法正确的是( )
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘少.下列说法正确的是( )| A. | 液滴中的Cl-由a区向b区迁移 | |
| B. | 液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-═4OH- | |
| C. | 液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH-形成Fe(OH)2,进一步氧化、脱水形成铁锈 | |
| D. | 若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e-═Cu2+ |

 ,其酸性比乙酸强.据此请回答:
,其酸性比乙酸强.据此请回答: COOH+2Na→NaO
COOH+2Na→NaO