题目内容
12. 物质的结构决定性质,性质反映其结构特点.
物质的结构决定性质,性质反映其结构特点.(1)氮族元素包括N、P、As、Sb和Bi五种元素.
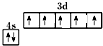
①基态N原子的价电子排布图为
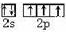 .
.②下列关于氮族元素的说法正确的是d.
a.N2可用于填充霓虹灯.其发光原理是电子从能量较低的轨道跃迁到能量较高的轨道,以光的形式释放能量
b.P、N、S三种元素的第一电离能由大到小的顺序是:P>S>N
c.基态As原子中,电子占据的最高能级为4d
d.Bi原子中最外层有5个运动状态不同的电子
(2)金刚石和石墨是碳元素的两种常见单质,下列叙述中正确的有ac
a.金刚石中碳原子的杂化类型为sp3杂化,石墨中碳原子的杂化类型为sp2
b.晶体中共价键的键长:金刚石中C-C<石墨中C-C;
c.晶体的熔点:金刚石<石墨
d.晶体中共价键的键角:金刚石>石墨
(3)某石蕊的分子结构如图所示.
①石蕊分子所含元素中,基态原子2p轨道有两个成单电子的是碳、氧(填元素名称); 由其中两种元素形成的三角锥构型的一价阳离子是H3O+(填化学式);
②该石蕊易溶解于水,分析可能的原因是石蕊分子中含有-OH和-NH2,均能与H2O形成氢键;由结构知,该分子为极性分子,根据相似相溶原理,易溶于水.
分析 (1)①N原子核外价电子数为5,处于2p能级上的3个电子应尽可能分占3个不同2p原子轨道,且自旋状态相同;
②a.根据能量守恒和电子能级跃迁原理,只有当电子从能量较高的轨道跃迁到能量较低的轨道,才能以光的形式释放能量,据此判断;
b.同周期自左而右元素的第一电离能呈增大趋势,但ⅡA族最外层为ns能级容纳2个电子,为全满确定状态,能量较低,第一电离能高于同周期相邻元素,ⅤA族np能级容纳3的电子,为半满稳定状态,能量较低,第一电离能也高于同周期相邻元素,同主族自上而下电离能降低;
c.基态As原子的核外电子排布式为1s22s22p63s23p63d104s24p3,据此作判断;
d.Bi原子为第ⅤA族第六周期,它的最外层的电子排布为:6s26p3,处于不同轨道;
(2)A.金刚石中碳原子与四个碳原子形成4个共价单键,构成正四面体;P石墨中的碳原子与相邻的三个碳原子以σ键结合,形成平面正六边形结构;
B.sp2杂化中,s轨道的成分比sp3杂化更多,而且石墨的碳原子还有大π键所以形成的共价键更短;
C.键长越短,键越牢固;
D.金刚石中碳原子与四个碳原子形成4个共价单键,构成正四面体,石墨中的碳原子与相邻的三个碳原子成键,形成正六角形的平面层状结构.
(3)①石蕊分子所含元素中,基态原子2p轨道有两个成单电子的是C或O元素;由其中两种元素形成的三角锥构型的一价阳离子中价层电子对个数是4且含有一个孤电子对;
②氢键的存在导致物质的溶解性增大,再结合相似相溶原理分析.
解答 解:(1)①N原子核外价电子数为5,分别位于2s、2p轨道,其价电子排布图为 ,故答案为:
,故答案为: ;
;
②a.根据能量守恒和电子能级跃迁原理,只有当电子从能量较高的轨道跃迁到能量较低的轨道,才能以光的形式释放能量,故a错误;
b.根据元素周期律,P、S两种元素位于同一周期,但P最外层处于半充满状态,第一电离能:S<P,P、N两种元素位于同一主族,第一电离能:P<N,故b正确;
c.基态As原子的核外电子排布式为1s22s22p63s23p63d104s24p3,电子占据的最高能级为4p,故c错误;
d.Bi原子为第ⅤA族第六周期,它的最外层的电子排布为:6s26p3,处于不同轨道,5个电子运动状态不同,故d正确;
故答案为:d;
(2)a.金刚石中碳原子与四个碳原子形成4个共价单键,构成正四面体,碳原子的杂化类型为sp3杂化;石墨中的碳原子与相邻的三个碳原子以σ键结合,形成平面正六边形结构,碳原子的杂化类型为sp2杂化,故a正确;
b.sp2杂化中,s轨道的成分比sp3杂化更多,而且石墨的碳原子还有大π键所以形成的共价键更短,更牢固,即石墨的层内C-C键长<金刚石中C-C键长,故b错误;
c.石墨的层内共价键键长比金刚石的键长短,作用力更大,破坏化学键需要更大能量,所以晶体的熔点金刚石<石墨,故c正确;
d.金刚石中碳原子与四个碳原子形成4个共价单键,构成正四面体,键角为109°28′,石墨中的碳原子用sp2杂化轨道与相邻的三个碳原子以σ键结合,形成正六角形的平面层状结构,键角为120°,故d错误.
故选:ac.
(3)①石蕊分子所含元素中,基态原子2p轨道有两个成单电子的是C、O元素;由其中两种元素形成的三角锥构型的一价阳离子中价层电子对个数是4且含有一个孤电子对,该微粒为H3O+,故答案为:碳 氧;H3O+;
②石蕊分子中含有-OH和-NH2,均能与H2O形成氢键,氢键的存在导致物质的溶解性增大;由结构知,该分子为极性分子,根据相似相溶原理,石蕊易溶于水,
故答案为:石蕊分子中含有-OH和-NH2,均能与H2O形成氢键;由结构知,该分子为极性分子,根据相似相溶原理,易溶于水.
点评 本题考查了元素周期律、分子结构、晶体类型与熔沸点高低判断、晶体结构、杂化类型的判断等,中等难度,注意把握金刚石和石墨的晶胞图,需要学生具备空间想象能力,知道相似相溶原理及氢键对物质性质的影响等知识点,注意基础知识的理解掌握.

 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案| A. | 离子化合物中可能含有共价键,共价化合物中可能含有离子键 | |
| B. | 一定条件下1 mol N2与3 mol H2在密闭容器中充分反应可生成2 mol NH3 | |
| C. | 铁质器件附有铜质配件,在接触处易生铁锈 | |
| D. | 非极性共价键只存在于双原子单质分子里 |
 一定温度下,2L的密闭容器中,发生反应:A2(g)+3B2(g)?2AB3(g).A2在5min内物质的量由12mol变成了4mol.
一定温度下,2L的密闭容器中,发生反应:A2(g)+3B2(g)?2AB3(g).A2在5min内物质的量由12mol变成了4mol.(1)该反应在这5min内的平均反应速率v(A2)=0.8 mol/(L•min).
(2)经过一段时间反应达到化学平衡状态,下列说法能充分说明该反应已达到化学平衡状态的是④.(填序号)
①A2、B2、AB3的浓度相等 ②正、逆反应速率均等于零
③A2、B2、AB3在容器中共存 ④A2、B2、AB3的浓度均不再改变
(3)下列条件不能改变该化学反应的限度的是④.(填序号)
①温度 ②浓度 ③压强 ④催化剂
(4)下列与改变化学反应速率无关的是③.(填序号)
①将食物存放在温度低的地方
②淀粉在淀粉酶的作用下发生水解反应
③铁粉与水蒸气的反应中,增加铁粉的用量
④将两种块状固体药品研细并混匀后再进行反应
(5)实验室可以利用稀硫酸与锌反应制取氢气.
①实验室用30%的稀硫酸溶液与锌粒反应制取氢气,反应进行一段时间后,气泡边得稀少了,锌粒还有剩余,再添加一些适当浓度的硫酸溶液到反应容器中,气泡又增多,其原因是浓度越大反应速率快.
②某学生为了探究锌与稀硫酸反应过程中速率变化.在100mL稀硫酸中加入足量的锌粉,标准状况下测得数据累计值如下:
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
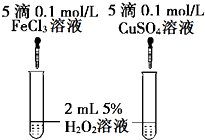
(6)经研究知Cu2+对H2O2分解具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学设计了如图甲、乙所示的实验.通过观察反应产生气泡的快慢,可定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是控制阴离子相同,排除阴离子的干扰.

| A. | 加水稀释至溶液体积为200 mL,醋酸溶液的pH变为4 | |
| B. | 温度都升高20℃后,两溶液的pH不再相等 | |
| C. | 加水稀释至溶液体积为200 mL后,两种溶液中c(OH-)都减小 | |
| D. | 加足量的锌充分反应后,两溶液中产生的氢气体积可用右图表示 |
| A. |  2,4-二硝基甲苯 2,4-二硝基甲苯 | B. | (CH3CH2)2CHCH33-甲基戊烷 | ||
| C. |  1,3-二甲基-2-丁烯 1,3-二甲基-2-丁烯 | D. |  异戊烷 异戊烷 |
| A. | Ca2+的结构示意图为: | |
| B. | 氯仿的化学式:CHCl3 | |
| C. | R2+离子核外有a个电子,b个中子,R原子表示为a+ba+b+2R | |
| D. | 溴化氢分子的电子式: |
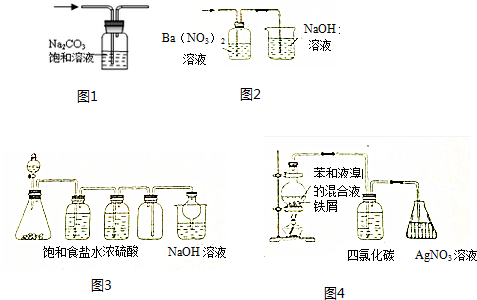
| A. | 用图1装置出去CO2中混有的HCl气体 | |
| B. | 用图2装置除去SO2中混有的SO3气体 | |
| C. | 用图3装置可以制备并收集Cl2 | |
| D. | 用图4装置证明苯与液溴能发生取代反应 |

 .
.
 ,与D同周期的所有元素的基态原子中最外层电子数与D原子相同的元素有8种.
,与D同周期的所有元素的基态原子中最外层电子数与D原子相同的元素有8种.