题目内容
2.合成氨是人类科技发展史上的一项重大突破.已知:25℃时,合成氨反应的热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol.请回答下列问题:①其它条件不变时,升高温度,化学反应速率增大(填“增大”或“减小”);
②25℃时,取1mol N2和3mol H2置于2L的密闭容器中,在催化剂存在下进行反应,达到平衡时放出的热量C
A.大于92.4kJ B.等于92.4kJ C.小于92.4kJ
③一定条件下,上述反应达到化学平衡状态的标志是B;
A.N2、H2、NH3的浓度相等 B.容器内压强不再变化
C.单位时间内消耗amol N2,同时生成2amol NH3
④25℃时,上述反应平衡常数的表达式为:K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$.
分析 ①影响化学反应速率的因素是增大物质浓度、升高温度、气体反应增大压强,增大接触面积等都可以加快反应速率;
②合成氨的反应为可逆反应,反应物不可能完全转化成生成物判断该反应放出的热量;
③当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变,注意反应物与生成物的化学计量数关系;
④平衡常数等于生成物浓度幂之积除以反应物浓度幂之积,固体和纯液体不写入表达式.
解答 解:①其它条件不变时,升高温度,化学反应速率增大,正逆反应速率都增大,只是正逆反应速率增大程度不同;
故答案为:增大;
②由N2(g)+3H2(g)?2NH3(g),△H=-92.4kJ/mol可知,生成2mol氨气放出92.4kJ热量,l molN2和3molH2放在密闭容器中,在催化剂存在下进行反应,由于可逆反应不可能完全转化,所以生成氨气的物质的量小于2mol,放出的热量小于92.4kJ;
故答案为:C;
③合成氨反应的热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol.反应是气体体积减小的放热反应;
A、平衡时各物质的物质的浓度取决于起始配料比以及转化的程度,N2、H2、NH3的浓度相等,不能作为判断是否达到平衡状态的依据,故A错误;
B、反应物和生成物的物质的量不相等,当压强不变时,说明各物质的量不再发生变化,反应达到平衡状态,故B正确;
C、单位时间内消耗amol N2,同时生成2amol NH3,反应正向进行,正逆反应速率不相等,没有达到平衡状态,故C错误;
故答案为:B.
④平衡常数等于生成物浓度幂之积除以反应物浓度幂之积,N2(g)+3H2(g)?2NH3(g),反应的平衡常数=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$;
故答案为:$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$.
点评 本题考查化学反应速率、化学平衡以及平衡常数等知识,为高频考点,侧重于学生的分析能力的考查,难度不大,注意化学平衡标志的判断、化学平衡和反应速率影响因素相关基础知识的积累,把握平衡常数的意义,题目难度中等.

 考前必练系列答案
考前必练系列答案| A. | 利用一束强光照射明矾溶液,产生光亮的“通路”,说明明矾一定发生了水解 | |
| B. | 与Al反应放出H2的溶液中Mg2-、Ca2-、HCO3-、NO3-有可能大量共存 | |
| C. | Ca(ClO)2溶液中通入过量SO2的离子方程式:ClO-+SO2+H2O=HClO+HSO3- | |
| D. | 等体积、等物质的量浓度的NaX的弱酸HX混合后的溶液中c(Na+)>c(HX)>c(H+)>c(OH-) |
| A. | 用食醋除去热水瓶中的水垢:CO32-+2CH3COOH═2CH3COO-+CO2↑+H2O | |
| B. | Al溶于NaOH溶液:Al+2OH-═AlO2-+H2↑ | |
| C. | Cl2溶于水:Cl2+H2O═H++Cl-+HClO | |
| D. | NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
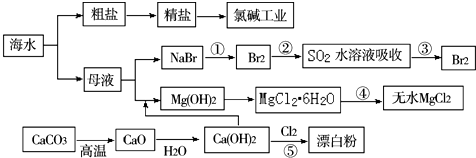
| A. | Cl2、漂白粉和SO2均可以漂白有色物质,且漂白的原理相同 | |
| B. | 氯碱工业就是指工业上电解饱和食盐水的方法制取NaOH、Cl2、H2的过程 | |
| C. | 工段④必须在干燥的HCl气流中加热才能制取无水MgCl2 | |
| D. | 工段①②③发生的反应均为氧化还原反应,且溴元素均被氧化 |
| A. | 标准状况下,向0.1mol•L -1的醋酸溶液中加入醋酸钠晶体,若混合液的pH=7,则该溶液中c(Na+)>c(CH3COO-) | |||||||||||
| B. | 根据下表中有关共价键的键能:
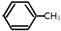 (g)+3H2(g)→ (g)+3H2(g)→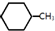 (g)的△H=-348kJ•mol-1 (g)的△H=-348kJ•mol-1 | |||||||||||
| C. | 一定量的复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,在某一时刻,反应的离子方程式可能是2Fe3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Fe(OH)3↓ | |||||||||||
| D. | 已知:25°C,Ksp(BaSO4)=1×10-10,向该温度下的饱和BaSO4溶液中加入一定量的硫酸钠或氯化钡固体后使Ksp(BaSO4)增大 |
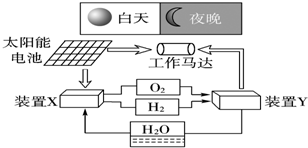
| A. | 二氧化硅是太阳能电池的光电转换材料 | |
| B. | 装置X能实现燃料电池的氢气和氧气再生 | |
| C. | 装置Y中负极的电极反应式为:O2+2H2O+4e-═4OH- | |
| D. | 装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化 |
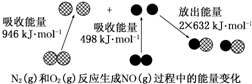
下列说法正确的是( )
| A. | 1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ | |
| B. | 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 | |
| C. | 通常情况下,N2(g)和O2(g)混合能直接生成NO(g) | |
| D. | NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
| A. | 常温下,铁与浓硝酸发生钝化,常用铁罐车运输浓硝酸 | |
| B. | SO2有漂白性,常用它来漂白纸浆 | |
| C. | 硅酸钠溶液呈碱性,常用做木材的防火剂 | |
| D. | Al具有良好的延展性和抗腐蚀性,常用铝箔包装物品 |
①向2mL 0.1mol•L-1 K2Cr2O7溶液中滴入3滴6mol•L-1 NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色.
②向2mL 0.1mol•L-1 酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,溶液由橙色变为绿色,发生反应:Cr2O72-+14H++6Fe2+═2Cr3+(绿色)+6Fe3++7H2O.
下列分析正确的是( )
| A. | 实验①和②均能证明K2Cr2O7溶液中存在上述平衡 | |
| B. | 实验②能说明氧化性:Cr2O72->Fe3+ | |
| C. | CrO42-和Fe2+在酸性溶液中可以大量共存 | |
| D. | 稀释K2Cr2O7溶液时,溶液中各离子浓度均减小 |