题目内容
16.下列指定反应的离子方程式正确的是( )| A. | 向烧碱溶液中加入铝:Al+2OH-=AlO2-+H2↑ | |
| B. | 用过量氨水吸收烟道气中的SO2:SO2+2NH3•H2O=SO32-+2NH4++H2O | |
| C. | 将饱和FeCl3溶液滴入废水中制取Fe(OH)3胶体:Fe3++3H2O?Fe(OH)3↓+3H+ | |
| D. | 用Fe2+将饮用水中少量ClO2-还原成为Cl-:4Fe2++ClO2-+4H+=4Fe3++Cl-+2H2O |
分析 A.电荷不守恒;
B.过量氨水与二氧化硫反应生成亚硫酸铵;
C.氢氧化铁胶体不是沉淀,不能标沉淀符号;
D.ClO2-氧化二价铁离子生成三价铁离子,本身被还原为氯离子,同时生成氢氧根离子.
解答 解:A.向烧碱溶液中加入铝,离子方程式:2H2O+2Al+2OH-=2AlO2-+3H2↑,故A错误;
B.用过量氨水吸收烟道气中的SO2,离子方程式:SO2+2NH3•H2O=SO32-+2NH4++H2O,故B正确;
C.将饱和FeCl3溶液滴入废水中制取Fe(OH)3胶体,离子方程式:Fe3++3H2O?Fe(OH)3(胶体)+3H+,故C错误;
D.用Fe2+将饮用水中少量ClO2-还原成为Cl-,离子方程式:2H2O+4Fe2++ClO2-=4Fe3++Cl-+4OH-,故D错误;
故选:B.
点评 本题考查了离子方程式的书写,注意制备氢氧化铁胶体时不能用沉淀符合,题目难度不大.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
6.下列说法正确的是( )
| A. | 油脂、糖类和蛋白质是三大营养物质,都能发生水解;被称作“人体核武器”的维生素B2含有肽键结构等,也能发生水解 | |
| B. |  、 、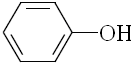 和 和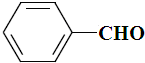 ,仅第一种能使KMnO4酸性溶液褪色 ,仅第一种能使KMnO4酸性溶液褪色 | |
| C. | 氨基酸主要以内盐形式存在,调节溶液的pH不可改变它在水中的溶解度 | |
| D. | 体检报告单中的“甘油三酯”是甘油的衍生物,其中甘油结构简式是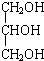 |
7.如图是一种航天器能量储存系统原理示意图.下列说法正确的是( )
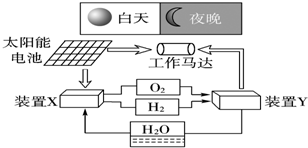

| A. | 二氧化硅是太阳能电池的光电转换材料 | |
| B. | 装置X能实现燃料电池的氢气和氧气再生 | |
| C. | 装置Y中负极的电极反应式为:O2+2H2O+4e-═4OH- | |
| D. | 装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化 |
11.下列有关物质的性质与应用对应关系不正确的是( )
| A. | 常温下,铁与浓硝酸发生钝化,常用铁罐车运输浓硝酸 | |
| B. | SO2有漂白性,常用它来漂白纸浆 | |
| C. | 硅酸钠溶液呈碱性,常用做木材的防火剂 | |
| D. | Al具有良好的延展性和抗腐蚀性,常用铝箔包装物品 |
1. 我国从国外进口某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大.元素A、B、C、D、E的原子结构等信息如下:
我国从国外进口某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大.元素A、B、C、D、E的原子结构等信息如下:
请回答下列问题:(用A、B、C、D、E,所对应的元素符号作答)
(1)B、C、D第一电离能由大到小为N>O>C.
(2)E的二价离子的电子排布式为1s22s22p63s23p63d9.
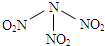
(3)A2B2D4常用作除锈剂,该分子中B的杂化方式为sp2;1molA2B2D4分子中含有σ键数目为7×6.02×1023.
(4)与化合物BD互为等电子体的阴离子化学式为CN-等;
(5)B2A6、C2A4分子中均含有18个电子,它们的沸点相差较大,主要原因是N2H4分子之间存在氢键.
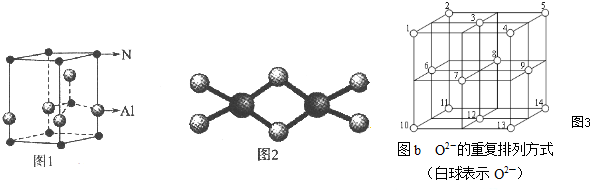
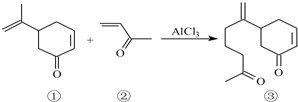
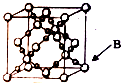
(6)BD2在高温高压下所形成晶体的晶胞如图所示,一个该晶胞中含16个D原子.
 我国从国外进口某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大.元素A、B、C、D、E的原子结构等信息如下:
我国从国外进口某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大.元素A、B、C、D、E的原子结构等信息如下:| 元素 | 元素性质或原子结构 |
| A | 周期表中原子半径最小的元素 |
| B | 原子核外有三种不同的能级且各个能级所填充的电子数相同 |
| C | 最外层P轨道半充满 |
| D | 位于短周期,其原子的核外成对电子数是未成对电子数的3倍 |
| E | 位于ds区且原子的最外层电子数与A的相同 |
(1)B、C、D第一电离能由大到小为N>O>C.
(2)E的二价离子的电子排布式为1s22s22p63s23p63d9.
(3)A2B2D4常用作除锈剂,该分子中B的杂化方式为sp2;1molA2B2D4分子中含有σ键数目为7×6.02×1023.
(4)与化合物BD互为等电子体的阴离子化学式为CN-等;
(5)B2A6、C2A4分子中均含有18个电子,它们的沸点相差较大,主要原因是N2H4分子之间存在氢键.
(6)BD2在高温高压下所形成晶体的晶胞如图所示,一个该晶胞中含16个D原子.
8.一定量Na2O2和NaHCO3,均匀混合物分成质量相等的甲乙两份.将甲投入100ml稀盐酸,固体完全溶解,收集到标准状况下干燥气体2.24L.再将生成气体全部导入装有乙的干燥管中,充分吸收后,收集到一种单质气体,标准状况下体积为2.016L.根据以上信息,下列有关推断不正确的是( )
| A. | 甲乙两份混合物中均含Na2O20.16mol | |
| B. | 甲乙两份混合物中均含NaHCO30.02mol | |
| C. | 原混合物中Na2O2与NaHCO3物质的量之比无法确定 | |
| D. | 盐酸物质的量浓度可能为3.4mol/L |
5.利用如图实验装置,能得出相应实验结论的是( )
| ① | ② | ③ | 实验结论 | 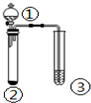 | |
| A | 盐酸 | Na2S | 硫酸铜溶液 | 稳定性:HCl>H2S | |
| B | 浓盐酸 | KMnO4 | KI-淀粉溶液 | 氧化性:KMnO4>Cl2>I2 | |
| C | 浓硫酸 | C | 澄清石灰水 | 浓硫酸具有强氧化性 | |
| D | 浓硝酸 | Cu | KI-淀粉溶液 | 氧化性:NO2>KI |
| A. | A | B. | B | C. | C | D. | D |
6.常温下,在10mL 0.1mol•L-1 NaHSO3溶液中逐滴滴加0.1mol•L-1 NaOH溶液,反应过程中溶液pH随NaOH的滴入变化如图所示,下列说法不正确的是( )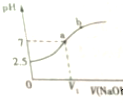

| A. | NaHSO3溶液呈酸性 | B. | V1<10mL | ||
| C. | 在a点,c(Na+)=c(SO32- )+c(HSO3-) | D. | 在b点,c(Na+)>c(SO3 2- ) |