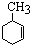题目内容
17.表1是元素周期表的一部分( 注意:以下各空所涉及的元素填元素符号,不能用字母代替)族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O族 |
| 1 | ||||||||
| 2 | G | H | D | |||||
| 3 | B | C | E | |||||
| 4 | F | A | ||||||
(2)C的离子的结构示意图
 ,
,(3)用电子式表示AE2的形成过程
 G元素的最高价氧化物电子式
G元素的最高价氧化物电子式
(4)H元素的单质的电子式
 ;H的氢化物的电子式
;H的氢化物的电子式
(5)A-H八种元素中(填化学式)
(a) 原 子 半径最大的元素是K,原子半径最小的元素是F.
(b)单质的还原性最强的元素是K,单质的氧化性最强的元素是F2
(c)酸性最强的最高价氧化物对应水化物是HClO4;
碱性最强的最高价氧化物对应水化物是KOH.
(6)请设计实验比较B、F的金属性强弱顺序.
| 元素 | 实验设计 | 现象 | 结论 |
| B | 分别在两个盛有滴加酚酞的水的烧杯中加入形状相同的Na和K,观察现象 | K在反应中伴随轻微爆炸,钾比钠的反应更剧烈 | 金属性: K>Na |
| F |
分析 由元素所在的周期和族可知:A为钙,B为钠,C为铝,D为氟,E为氯,F为钾,G为碳,H为氮,
(1)C为铝,元素符号为Al;
(2)Al为13号元素,失去3个电子形成离子;
(3)氯化钙为离子化合物,有电子的得失,据此书写形成过程,二氧化碳为共价化合物,据此书写即可;
(4)氮气分子中存在氮氮三键,氮原子最外层为8电子;氨气中形成3对共价键,N上有一对孤电子对,据此书写即可;
(5)元素的非金属性越强,还原性越强,其对应最高价氧化物的水化物的碱性越强,元素的非金属性越强,其对应最高价氧化物的水化物得到酸性越强,电子层数越多,半径越大,同一周期,原子序数越小,半径越大,据此解答即可;
(6)依据两种金属与水反应的剧烈程度设计方案即可.
解答 解:由元素所在的周期和族可知:A为钙,B为钠,C为铝,D为氟,E为氯,F为钾,G为碳,H为氮,
(1)C为铝,元素符号为:Al,故答案为:Al;
(2)Al原子序数为13,失去最外层3个电子后形成带3个正电荷的阳离子,离子结构示意图为: ,故答案为:
,故答案为: ;
;
(3)氯化钙为离子化合物,用电子式其形成过程为 ,CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子,其电子式为
,CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子,其电子式为 ,故答案为:
,故答案为: ;
; ;
;
(4)N2的电子式为: ,NH3的电子式为:
,NH3的电子式为: ,故答案为:
,故答案为: ;
; ;
;
(5)(a)原 子 半径最大的元素是K,原子半径最小的元素是F,故答案为:K;F;
(b)单质的还原性最强的元素是K,单质的氧化性最强的元素是F2,故答案为:K;F2;
(c)酸性最强的最高价氧化物对应水化物是HClO4,碱性最强的最高价氧化物对应水化物是KOH,故答案为:HClO4;KOH;
(6)B为第三周期ⅠA族元素,为Na元素,F为第四周期ⅠA族元素,为K元素,同主族元素从上到下,元素的金属性逐渐增强,对应的最高价氧化物的水化物的碱性逐渐增强,元素的金属性越强,其对应的单质与水反应越剧烈.故答案为:将Na和K分别投入冷水中,观察反应现象;K在反应中伴随轻微爆炸,钾比钠的反应更剧烈; K>Na.
点评 本题主要考查元素的位置和性质的关系,题目难度不大,注意同主族元素的性质的递变规律及其比较方法的实验设计.

 阅读快车系列答案
阅读快车系列答案| A. | 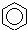 +HNO3$→_{△}^{浓硫酸}$ +HNO3$→_{△}^{浓硫酸}$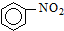 +H2O;取代反应 +H2O;取代反应 | |
| B. | CH4+Cl2→CH3Cl+HCl;置换反应 | |
| C. | CH2=CH2+HCl→CH3-CH2Cl;加成反应 | |
| D. | 2CH3CH2OH+O2$\stackrel{Cu}{→}$2CH3CHO+2H2O;氧化反应 |
(1)250℃时,以镍合金为催化剂,向4L容器中通入6molCO2、6molCH4,发生反应:CO2(g)+CH4(g)?2CO(g)+2H2(g).平衡体系中各组分物质的量如表:
| 物质 | CH4 | CO2 | CO | H2 |
| 物质的量mol | 2 | 2 | 8 | 8 |
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1
CO(g)+H2O(g)=CO2(g)+H2(g)△H=+2.8kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ.mol-1
反应CO2(g)+CH4(g)?2CO(g)+2H2(g)的△H=+247.3 kJ•mol-1.
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂.可以将CO2和CH4直接转化为成乙酸.
①在不同温度下催化剂的催化效果与乙酸的生成速率如图1所示.250~300℃时,温度升高而乙酸的生成速率降低的原因是温度超过250℃时,催化剂的催化效率降低.
②为了提高该反应中CH4的转化率,可以采取的措施是缩小体积增大压强或增大CO2的浓度.
(3)①Li2O、Na2O、MgO均能吸收CO2.如果寻找吸收CO2的其他物质,下列建议合理的是ab.
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c可在具有强氧化性的物质中寻找
②Li2O吸收CO2后,产物用于合成Li4SiO4用于吸收、释放CO2.原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3和另一种盐;平衡后加热至700℃,反应逆向进行放出CO2,Li4SiO4再生,写出CO2和Li4SiO4反应的化学方程式CO2+Li4SiO4$\frac{\underline{\;500℃\;}}{\;}$Li2CO3+Li2SiO3.
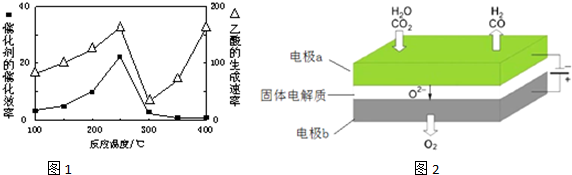
(4)反应A:CO2+H2O$\frac{\underline{\;电解\;}}{高温}$CO2+H2+O2利用反应A可将释放的CO2转化为具有工业利用价值的产品.高温电解技术能高效实现反应A,工作原理示意图如图2.CO2在电极a放电的反应式是CO2+2e-═CO+O2-.
| A. | 利用一束强光照射明矾溶液,产生光亮的“通路”,说明明矾一定发生了水解 | |
| B. | 与Al反应放出H2的溶液中Mg2-、Ca2-、HCO3-、NO3-有可能大量共存 | |
| C. | Ca(ClO)2溶液中通入过量SO2的离子方程式:ClO-+SO2+H2O=HClO+HSO3- | |
| D. | 等体积、等物质的量浓度的NaX的弱酸HX混合后的溶液中c(Na+)>c(HX)>c(H+)>c(OH-) |
| A. | Si、P、S元素的最高正价依次降低 | |
| B. | Li、Na、K的原子半径依次增大 | |
| C. | C、O、N的原子半径依次减小 | |
| D. | Na、Mg、Al原子的最外层电子数依次减少 |
| A. | 油脂、糖类和蛋白质是三大营养物质,都能发生水解;被称作“人体核武器”的维生素B2含有肽键结构等,也能发生水解 | |
| B. | 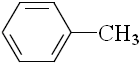 、 、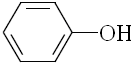 和 和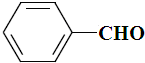 ,仅第一种能使KMnO4酸性溶液褪色 ,仅第一种能使KMnO4酸性溶液褪色 | |
| C. | 氨基酸主要以内盐形式存在,调节溶液的pH不可改变它在水中的溶解度 | |
| D. | 体检报告单中的“甘油三酯”是甘油的衍生物,其中甘油结构简式是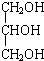 |
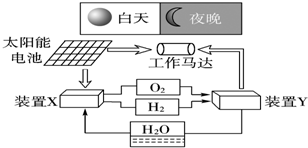
| A. | 二氧化硅是太阳能电池的光电转换材料 | |
| B. | 装置X能实现燃料电池的氢气和氧气再生 | |
| C. | 装置Y中负极的电极反应式为:O2+2H2O+4e-═4OH- | |
| D. | 装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化 |
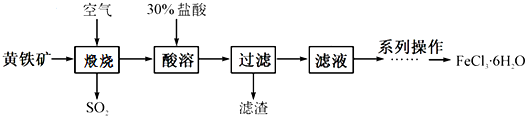
 ,已知B、C、D、E、F五种烃有如下转化关系,B为苯的同系物,最多只有13个原子处于同一平面上,D中所有的原子一定在同一平面上.
,已知B、C、D、E、F五种烃有如下转化关系,B为苯的同系物,最多只有13个原子处于同一平面上,D中所有的原子一定在同一平面上.
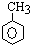 +3H2$→_{△}^{Ni}$
+3H2$→_{△}^{Ni}$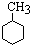
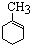 _
_