题目内容
15.【材料一】工业上从海产品(海带)中获取碘的流程图如图1: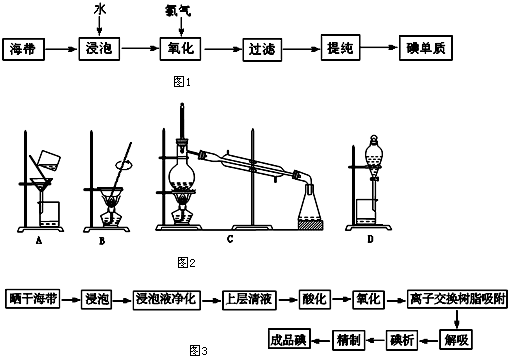
(1)上述生产流程的第一步是“浸泡”,它的实验目的是使海带中的I-溶于水;
(2)“氧化”这一操作中可供选用的试剂如下,请你选择的最合适试剂D;
A.Cl2 B.Br2 C.浓硫酸 D.H2O2(滴加稀硫酸),
(3)上述的生产流程中,“提纯获得单质碘”一般认为经历两步,你认为应选择图2实验装置分别是D、C (按操作的先后顺序填写);
【材料二】我国实际工业利用海带制取碘,采用的是离子交换法,其流程如图3:
(4)实际工业生产中,酸化、氧化的方法是先加入硫酸酸化,使pH降低到2,然后加入次氯酸钠一类的氧化剂使碘离子氧化,反应的离子方程式:2I-+ClO-+2H+=I2+Cl-+H2O;
(5)上述的生产流程中离子交换树脂是用碱性树脂吸附,再用Na2SO3一类物质解吸,请问树脂吸附的碘元素状态是游离态(填写“游离态”或“化合态”).解吸后应加入氧化剂(填“氧化剂”或“还原剂”)可以实现碘析.请写出用Na2SO3解吸的化学方程式:Na2SO3+I2+H2O=Na2SO4+2HI或2NaI+H2SO4.
分析 海带中提取碘的过程再现,其基本过程是先将海带中的碘元素(以I-存在)提取到水溶液中,再用合适的氧化剂将I-氧化到I2(要防止将I2氧化到更高价态),然后用有机溶剂萃取碘单质,最后分离有机溶剂(分馏).所以,“浸泡”的实验目的是使海带中的I-溶于水;最好的氧化剂是H2O2,理由:能将I-氧化到I2而不能将I2氧化到更高价态(Cl2、Br2能将I2氧化到HIO3);绿色氧化剂,还原产物为H2O,对环境无污染(浓硫酸的还原产物为SO2).根据题意,离子交换树脂吸附的是I2,解吸是将I2转化为I-,碘析是将I-转化为I2析出;
(1)上述生产流程的第一步是“浸泡”,目的是把海带中的碘离子溶解形成溶液,从海带中获得碘离子;
(2)工业上从海产品(海带)中获取碘,能将I-氧化到I2而不能将I2氧化到更高价态(Cl2、Br2能将I2氧化到HIO3),需要选择绿色氧化剂,过氧化氢还原产物为H2O,对环境无污染;
(3)根据用萃取剂萃取碘单质和用蒸馏提取萃取剂中的碘进行解答;
(4)次氯酸钠中氯元素为+1价,具有强氧化性能氧化碘离子为碘单质;
(5)根据我国实际工业利用海带制取碘的流程图进行解答,离子交换树脂吸附的是I2,解吸是将I2转化为I-,碘析是将I-转化为I2析出;
解答 解:(1)将海带加水,经过浸泡后,就可用氯气氧化,氯气氧化的是碘离子,所以该操作是从海带中获得碘离子,
故答案为:使海带中的I-溶于水;
(2)Br2、Cl2氧化2I-+Cl2═I2+2Cl-,Br2+2I-=I2+2Br-,生成Cl-、Br-,对环境有污染,浓硫酸氧化碘离子为碘单质,引入硫酸根离子,双氧水(H2O2)可氧化碘离子,2I-+H2O2+2H+═I2+2H2O而自身被还原成水,符合无污染要求,
故答案为:D;
(3)提纯获得单质碘,先需用萃取剂萃取碘水中的碘,用分液漏斗组成的萃取装置,选D,从萃取剂中提取碘单质,需用蒸馏装置,需选C,
故答案为:DC;
(4)次氯酸钠中氯元素为+1价,具有强氧化性,可将碘离子氧化成单质碘,自身被还原成-1价的氯,方程式为2I-+ClO-+2H+═I2+H2O+Cl-,
故答案为:2I-+ClO-+2H+═I2+H2O+Cl-;
(5)从我国实际工业利用海带制取碘的流程图可知,用用碱性树脂吸附,是在碘离子氧化之后,说明此时吸附的是碘单质,所以属于游离态,再用亚硫酸钠一类还原剂解吸,说明碘单质发生还原反应,生成碘离子,所以需氧化剂实现碘析,用Na2SO3解吸的化学方程式Na2SO3+I2+H2O=Na2SO4+2HI或2NaI+H2SO4;
故答案为:游离态,氧化剂;Na2SO3+I2+H2O=Na2SO4+2HI或2NaI+H2SO4;
点评 本题主要考查从海带中提取碘的实验,明确物质的分离方法及碘单质的性质是解答的关键,掌握物质性质和实验过程是解题关键,题目难度中等.

(1)250℃时,以镍合金为催化剂,向4L容器中通入6molCO2、6molCH4,发生反应:CO2(g)+CH4(g)?2CO(g)+2H2(g).平衡体系中各组分物质的量如表:
| 物质 | CH4 | CO2 | CO | H2 |
| 物质的量mol | 2 | 2 | 8 | 8 |
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1
CO(g)+H2O(g)=CO2(g)+H2(g)△H=+2.8kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ.mol-1
反应CO2(g)+CH4(g)?2CO(g)+2H2(g)的△H=+247.3 kJ•mol-1.
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂.可以将CO2和CH4直接转化为成乙酸.
①在不同温度下催化剂的催化效果与乙酸的生成速率如图1所示.250~300℃时,温度升高而乙酸的生成速率降低的原因是温度超过250℃时,催化剂的催化效率降低.
②为了提高该反应中CH4的转化率,可以采取的措施是缩小体积增大压强或增大CO2的浓度.
(3)①Li2O、Na2O、MgO均能吸收CO2.如果寻找吸收CO2的其他物质,下列建议合理的是ab.
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c可在具有强氧化性的物质中寻找
②Li2O吸收CO2后,产物用于合成Li4SiO4用于吸收、释放CO2.原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3和另一种盐;平衡后加热至700℃,反应逆向进行放出CO2,Li4SiO4再生,写出CO2和Li4SiO4反应的化学方程式CO2+Li4SiO4$\frac{\underline{\;500℃\;}}{\;}$Li2CO3+Li2SiO3.
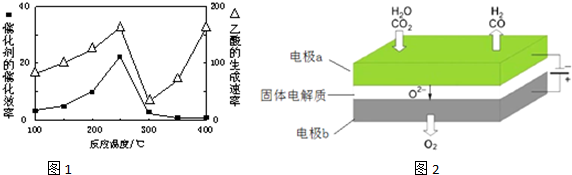
(4)反应A:CO2+H2O$\frac{\underline{\;电解\;}}{高温}$CO2+H2+O2利用反应A可将释放的CO2转化为具有工业利用价值的产品.高温电解技术能高效实现反应A,工作原理示意图如图2.CO2在电极a放电的反应式是CO2+2e-═CO+O2-.
| A. | 油脂、糖类和蛋白质是三大营养物质,都能发生水解;被称作“人体核武器”的维生素B2含有肽键结构等,也能发生水解 | |
| B. | 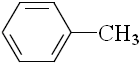 、 、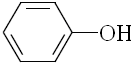 和 和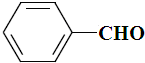 ,仅第一种能使KMnO4酸性溶液褪色 ,仅第一种能使KMnO4酸性溶液褪色 | |
| C. | 氨基酸主要以内盐形式存在,调节溶液的pH不可改变它在水中的溶解度 | |
| D. | 体检报告单中的“甘油三酯”是甘油的衍生物,其中甘油结构简式是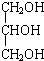 |
| A. | 3.9gNa2O2晶体中阴阳离子总数为0.15NA | |
| B. | 1.0L1.0mo1•L-1的NaNO3水溶液中含有的氧原子数为3NA | |
| C. | 25℃时pH=13的Ba(OH)2溶液中含有OH一的数目为0.1NA | |
| D. | 1 mol的羟基与1 mol的氢氧根离子所含电子数均为9NA |
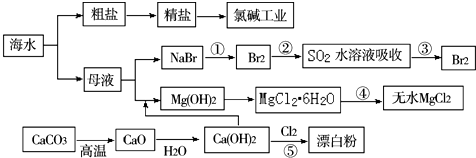
| A. | Cl2、漂白粉和SO2均可以漂白有色物质,且漂白的原理相同 | |
| B. | 氯碱工业就是指工业上电解饱和食盐水的方法制取NaOH、Cl2、H2的过程 | |
| C. | 工段④必须在干燥的HCl气流中加热才能制取无水MgCl2 | |
| D. | 工段①②③发生的反应均为氧化还原反应,且溴元素均被氧化 |
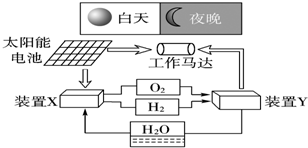
| A. | 二氧化硅是太阳能电池的光电转换材料 | |
| B. | 装置X能实现燃料电池的氢气和氧气再生 | |
| C. | 装置Y中负极的电极反应式为:O2+2H2O+4e-═4OH- | |
| D. | 装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化 |
| ① | ② | ③ | 实验结论 | 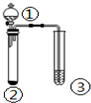 | |
| A | 盐酸 | Na2S | 硫酸铜溶液 | 稳定性:HCl>H2S | |
| B | 浓盐酸 | KMnO4 | KI-淀粉溶液 | 氧化性:KMnO4>Cl2>I2 | |
| C | 浓硫酸 | C | 澄清石灰水 | 浓硫酸具有强氧化性 | |
| D | 浓硝酸 | Cu | KI-淀粉溶液 | 氧化性:NO2>KI |
| A. | A | B. | B | C. | C | D. | D |