题目内容
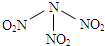
12.浓硝酸与浓盐酸混合过程中产生少量的气体单质X、化合物M和无色液体,化合物M中所有原子均达到8电子的稳定结构.2molM加热分解生成1molX和2mol无色气体Y,Y遇到空气呈现红棕色.(1)镁与气体X反应产物的电子式为
 .
.(2)浓硝酸和浓盐酸反应的化学方程式为HNO3+3HCl=NOCl+Cl2+2H2O.
(3)化合物M水解生成两种酸,为非氧化还原反应,该反应的化学方程式为NOCl+H2O=HNO2+HCl.
分析 Y遇到空气呈现红棕色,则Y为NO,浓硝酸与浓盐酸混合过程中会产生少量的气体单质X、化合物M和无色液体,则浓硝酸与浓盐酸发生氧化还原反应,化合物M中所有原子均达到8电子的稳定结构,2molM加热分解生成lmol X和2mol无色气体Y,根据元素守恒和电子得失守恒可推断,X为Cl2,M为NOCl,无色液体为水,据此答题.
解答 解:Y遇到空气呈现红棕色,则Y为NO,浓硝酸与浓盐酸混合过程中会产生少量的气体单质X、化合物M和无色液体,则浓硝酸与浓盐酸发生氧化还原反应,化合物M中所有原子均达到8电子的稳定结构,2molM加热分解生成lmol X和2mol无色气体Y,根据元素守恒和电子得失守恒可推断,X为Cl2,M为NOCl,无色液体为水,
(1)X为Cl2,镁与气体X反应产物为氯化镁,其的电子式为 ,
,
故答案为: ;
;
(2)浓硝酸和浓盐酸反应的化学方程式为HNO3+3HCl=NOCl+Cl2+2H2O,故答案为:HNO3+3HCl=NOCl+Cl2+2H2O;
(3)M为NOCl,M水解生成两种酸,为非氧化还原反应,根据化合价可知,应生成亚硝酸和盐酸,反应的化学方程式为NOCl+H2O=HNO2+HCl,
故答案为:NOCl+H2O=HNO2+HCl.
点评 本题考查了物质转化关系和物质性质的综合应用,主要考查了Cl、N的性质应用,题目难度中等,需要熟悉物质性质的特征反应,转化关系的分析判断.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案
相关题目
3.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 3.9gNa2O2晶体中阴阳离子总数为0.15NA | |
| B. | 1.0L1.0mo1•L-1的NaNO3水溶液中含有的氧原子数为3NA | |
| C. | 25℃时pH=13的Ba(OH)2溶液中含有OH一的数目为0.1NA | |
| D. | 1 mol的羟基与1 mol的氢氧根离子所含电子数均为9NA |
7.如图是一种航天器能量储存系统原理示意图.下列说法正确的是( )
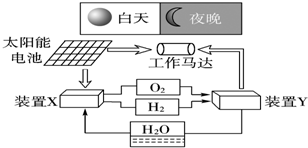

| A. | 二氧化硅是太阳能电池的光电转换材料 | |
| B. | 装置X能实现燃料电池的氢气和氧气再生 | |
| C. | 装置Y中负极的电极反应式为:O2+2H2O+4e-═4OH- | |
| D. | 装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化 |
17.下列溶液中粒子的物质的量浓度关系一定正确的是( )
| A. | 常温下,pH=9的NaHA溶液:c(Na+)>c(HA-)>c(H2A) | |
| B. | Na2CO3溶液:c(H+)-c(OH-)=c(HCO3-)+2c(CO32-)-c(Na+) | |
| C. | 向NaOH溶液中滴入CH3COOH溶液后溶液显碱性:c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 浓度均为0.1mol•L-1的HF溶液与KF溶液等体积混合:c(F-)+c(HF)=0.2mol•L-1 |
1. 我国从国外进口某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大.元素A、B、C、D、E的原子结构等信息如下:
我国从国外进口某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大.元素A、B、C、D、E的原子结构等信息如下:
请回答下列问题:(用A、B、C、D、E,所对应的元素符号作答)
(1)B、C、D第一电离能由大到小为N>O>C.
(2)E的二价离子的电子排布式为1s22s22p63s23p63d9.
(3)A2B2D4常用作除锈剂,该分子中B的杂化方式为sp2;1molA2B2D4分子中含有σ键数目为7×6.02×1023.
(4)与化合物BD互为等电子体的阴离子化学式为CN-等;
(5)B2A6、C2A4分子中均含有18个电子,它们的沸点相差较大,主要原因是N2H4分子之间存在氢键.
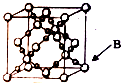
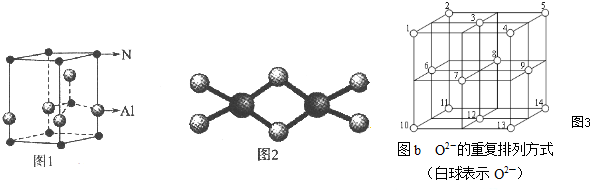
(6)BD2在高温高压下所形成晶体的晶胞如图所示,一个该晶胞中含16个D原子.
 我国从国外进口某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大.元素A、B、C、D、E的原子结构等信息如下:
我国从国外进口某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大.元素A、B、C、D、E的原子结构等信息如下:| 元素 | 元素性质或原子结构 |
| A | 周期表中原子半径最小的元素 |
| B | 原子核外有三种不同的能级且各个能级所填充的电子数相同 |
| C | 最外层P轨道半充满 |
| D | 位于短周期,其原子的核外成对电子数是未成对电子数的3倍 |
| E | 位于ds区且原子的最外层电子数与A的相同 |
(1)B、C、D第一电离能由大到小为N>O>C.
(2)E的二价离子的电子排布式为1s22s22p63s23p63d9.
(3)A2B2D4常用作除锈剂,该分子中B的杂化方式为sp2;1molA2B2D4分子中含有σ键数目为7×6.02×1023.
(4)与化合物BD互为等电子体的阴离子化学式为CN-等;
(5)B2A6、C2A4分子中均含有18个电子,它们的沸点相差较大,主要原因是N2H4分子之间存在氢键.
(6)BD2在高温高压下所形成晶体的晶胞如图所示,一个该晶胞中含16个D原子.
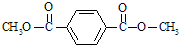
 ,已知B、C、D、E、F五种烃有如下转化关系,B为苯的同系物,最多只有13个原子处于同一平面上,D中所有的原子一定在同一平面上.
,已知B、C、D、E、F五种烃有如下转化关系,B为苯的同系物,最多只有13个原子处于同一平面上,D中所有的原子一定在同一平面上.
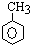 +3H2$→_{△}^{Ni}$
+3H2$→_{△}^{Ni}$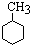
 _
_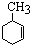
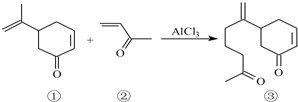
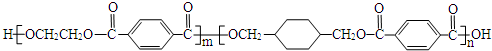
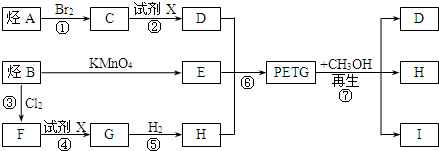
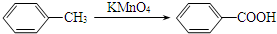
 .
.
 .
. .
.