题目内容
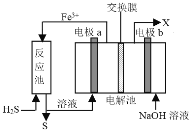
【题目】如图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d。符合上述实验结果的盐溶液是

选项 | X | Y |
A. | CuSO4 | AgNO3 |
B. | AgNO3 | NaCl |
C. | FeSO4 | Al2(SO4)3 |
D. | MgSO4 | CuSO4 |
A.AB.BC.CD.D
【答案】A
【解析】
电极b、d均为阴极,在它们上面均没有气体逸出,但质量均增大,且增重d>b,则所电解的盐溶液中金属元素应该在金属活动顺序表中(H)以后,转移相同电子时,b析出金属质量小于d,据此分析解答.
电极b、d均为阴极,在它们上面均没有气体逸出,但质量均增大,且增重d>b,则所电解的盐溶液中金属元素应该在金属活动顺序表中(H)以后,转移相同电子时,b析出金属质量小于d。阳离子得电子能力如图所示:
![]() ,前面的H+表示酸溶液中的H+,后面的H+表示盐溶液中的H+。
,前面的H+表示酸溶液中的H+,后面的H+表示盐溶液中的H+。
A.两池中的电极上转移的电子是相等的,设转移2mol电子,b增重64g,d增重216g,所以质量增加b<d,故A正确;
B.由阳离子得电子能力顺序表可以看出,盐溶液中Ag+得电子能力大于H+,因此电解硝酸银溶液时阴极b电极上生成Ag、电解NaCl溶液阴极d上生成氢气,两池中的电极上转移的电子是相等的,设转移2mol电子,b增重216g,d增重0g,所以质量增加b>d,故B错误;
C.在金属活动性顺序表中,Fe、Al都在H之前,电解亚铁盐、铝溶液溶液时阴极上都不能得到金属单质,故C错误;
D.在金属活动性顺序表中,Mg在H之前,所以电解镁盐溶液时阴极上不能得到金属单质,故D错误;
故选A。

【题目】某学习小组通过下列装置探究MnO2与FeCl3·6H2O能否反应产生Cl2。
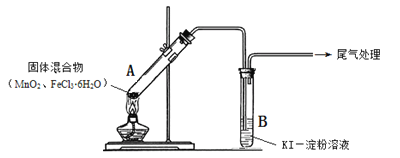
实验操作和现象:
操 作 | 现 象 |
点燃酒精灯,加热 | ⅰ.A中部分固体溶解,上方出现白雾 ⅱ.稍后,产生黄色气体,管壁附着黄色液滴 ⅲ.B中溶液变蓝 |
(1)现象ⅰ中的白雾是 ,形成白雾的原因是 。
(2)分析现象ⅱ,该小组探究黄色气体的成分,实验如下:
a.加热FeCl3·6H2O,产生白雾和黄色气体。
b.用KSCN溶液检验现象ⅱ和a中的黄色气体,溶液均变红。
通过该实验说明现象ⅱ中黄色气体含有 。
(3)除了氯气可使B中溶液变蓝外,推测还可能的原因是:
① 实验b检出的气体使之变蓝,反应的离子方程式是________________。实验证实推测成立。
② 溶液变蓝的另外一种原因是:在酸性条件下,装置中的空气使之变蓝。通过进一步实验确认了这种可能性,其实验方案是 。
(4)为进一步确认黄色气体是否含有Cl2,小组提出两种方案,均证实了Cl2的存在。
方案1:在A、B间增加盛有某种试剂的洗气瓶C。
方案2:将B中KI-淀粉溶液替换为NaBr溶液;检验Fe2+ 。
现象如下:
方案1 | B中溶液变为蓝色 |
方案2 | B中溶液呈浅橙红色;未检出Fe2+ |
①方案1的C中盛放的试剂是 。
②方案2中检验Fe2+ 的原因是 。
③综合方案1、2的现象,说明选择NaBr溶液的依据是 。
(5)将A中产物分离得到Fe2O3和MnCl2,A中产生Cl2的化学方程式是 。