题目内容
【题目】工业上用Na2SO3溶液吸收硫酸工业尾气中的SO2,并通过电解方法实现吸收液的循环再生。其中阴、阳离子交换膜组合循环再生机理如图所示,下列有关说法中正确的是
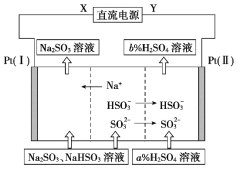
A.X应为直流电源的正极
B.电解过程中阴极区pH升高
C.图中的b%<a%
D.SO32-在电极上发生的反应为SO32-+2OH--2e-=SO42-+2H2O
【答案】B
【解析】
A. 因为电解池左室H+→H2,Pt(I)是阴极,X为直流电源的负极,A项错误;
B. 阴极区消耗H+生成氢气,氢离子浓度减小,溶液的pH增大,B项正确;
C. 电解池右室阳极区的发生反应HSO3--2e-+H2O=SO42-+3H+ 和SO32--2e-+2H2O=SO42-+4H+,图中的b%>a%,C项错误;
D. 解池右室阳极区的发生反应HSO3--2e-+H2O=SO42-+3H+ 和SO32--2e-+2H2O=SO42-+4H+,D项错误;
答案选B。

【题目】如图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d。符合上述实验结果的盐溶液是
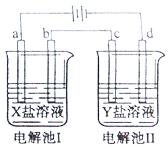
选项 | X | Y |
A. | CuSO4 | AgNO3 |
B. | AgNO3 | NaCl |
C. | FeSO4 | Al2(SO4)3 |
D. | MgSO4 | CuSO4 |
A.AB.BC.CD.D
【题目】运用化学反应原理研究碳、氮的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)反应ⅠFe(s)+CO2(g) ![]() FeO(s)+CO(g) ΔH1,平衡常数为K1;
FeO(s)+CO(g) ΔH1,平衡常数为K1;
反应ⅡFe(s)+H2O(g) ![]() FeO(s)+H2(g) ΔH2,平衡常数为K2;
FeO(s)+H2(g) ΔH2,平衡常数为K2;
在不同温度K1、K2值如下表:
700 ℃ | 900 ℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
①由表中判断,反应Ⅰ为中ΔH1______ (填“<”或“=”或“>”) 0。
②反应CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH平衡常数为K,则K=________(用K1和K2表示)。
CO(g)+H2O(g) ΔH平衡常数为K,则K=________(用K1和K2表示)。
③能判断CO2(g)+H2(g) ![]() CO(g)+H2O(g)达到化学平衡状态的依据是________(填字母)。
CO(g)+H2O(g)达到化学平衡状态的依据是________(填字母)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO)=c(CO2)
E.容器内的气体密度不变 F.混合气体的平均摩尔质量不变。
(2)在不同温度和压强下合成氨,起始时投入氮气和氢气的物质的量分别为1mol、3mol。平衡时混合物中氨的体积分数与温度的关系如图。
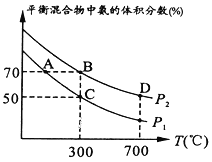
①P1_______P2 (填“>”“=” “<”或“不确定”,)。
②C点H2的转化率为________。