题目内容
【题目】法国一家公司研发出一种比锂电池成本更低、寿命更长、充电速度更快的钠离子电池,该电池的负极材料为Na2Co2TeO6(制备原料为Na2CO3、Co3O4和TeO2),电解液为NaClO4的碳酸丙烯酯溶液。回答下列问题:
(1)C、O、Cl三种元素电负性由大到小的顺序为________________________。
(2)基态Na原子中,核外电子占据的原子轨道总数为______,Te属于元素周期表中______区元素,其基态原子的价电子排布式为______________________。
(3)CO32-的空间构型为___________________,碳酸丙烯酯的结构简式如图所示,
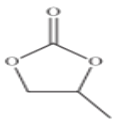
其中碳原子的杂化轨道类型为____________,1mol碳酸丙烯酯中σ键的数目为_________________。
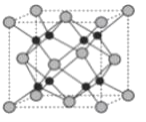
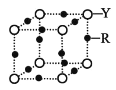
(4)Na和O形成的离子化合物的晶胞结构如图所示,晶胞中O的配位数为____________,该晶胞的密度为ρg/cm3,阿伏加德罗常数的值为NA,则Na与O之间的最短距离为____________cm(用含有ρ、NA的代数式表示)。
【答案】O>Cl>C (或OClC) 6 p 5s25p4 平面三角形 sp2、sp3 13NA(或13×6.02×1023) 8 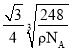
【解析】
(1)元素的非金属性越强其电负性越大,O、Cl、C的非金属性大小顺序是O>Cl>C,所以其电负性大小顺序是O>Cl>C;
(2)Na元素的原子序数为11,基态原子的电子排布式为:1s22s22p63s1,每个能级字母前的数字表示电子层数,所以该元素含有3个电子层,各能级包含的原子轨道数按s、p、d、f的顺序依次为1、3、5、7,该元素含有s、p能级,1+1+3+1=6个轨道;Te原子为52号元素,位于周期表第五周期、第VIA族,价电子排布式为5s25p4,属于p区;
(3)CO32-中碳原子价层电子对个数=3+![]() (4+2-3×2)=3,且不含孤电子对,所以C原子采用sp2杂化,空间构型为平面三角形;碳酸丙烯酯中碳原子为单键和双键,单键形成4个σ键,没有孤对电子,杂化轨道数目为4,为sp3杂化,双键形成3个σ键,没有孤对电子,杂化轨道数目为3,sp2杂化,所以碳原子的杂化轨道类型为sp2、sp3,σ键的总数目为13,即13NA(或13×6.02×1023);
(4+2-3×2)=3,且不含孤电子对,所以C原子采用sp2杂化,空间构型为平面三角形;碳酸丙烯酯中碳原子为单键和双键,单键形成4个σ键,没有孤对电子,杂化轨道数目为4,为sp3杂化,双键形成3个σ键,没有孤对电子,杂化轨道数目为3,sp2杂化,所以碳原子的杂化轨道类型为sp2、sp3,σ键的总数目为13,即13NA(或13×6.02×1023);
(4)氧离子半径大于钠离子半径,所以白色球为O,晶胞中白色球数目为8×![]() +6×
+6×![]() =4,黑色球为Na,共8个,由晶胞对称性可知O的配位数为8;根据晶胞结构可知Na周围距离最近的4个O形成正四面体,顶点O与正四面体体心的Na连线处于晶胞体对角线上,Na与O之间的最短距离为体对角线的
=4,黑色球为Na,共8个,由晶胞对称性可知O的配位数为8;根据晶胞结构可知Na周围距离最近的4个O形成正四面体,顶点O与正四面体体心的Na连线处于晶胞体对角线上,Na与O之间的最短距离为体对角线的![]() ,晶胞体积=
,晶胞体积=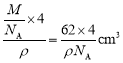 ,晶胞边长=
,晶胞边长=![]() cm,则Na与O之间的最短距离为
cm,则Na与O之间的最短距离为![]() cm。
cm。

【题目】下列实验操作能达到实验目的或得出相应结论的是
实 验 操 作 | 目的或结论 | |
A | 将Cu片放入FeCl3溶液中 | 证明Fe的金属性比Cu强 |
B | 将点燃的镁条置于盛有CO2的集气瓶中,瓶内壁有黑色固体生成 | 镁与CO2发生置换反应 |
C | 将SO2通入溴水或酸性高锰酸钾溶液中 | 证明SO2有漂白性 |
D | 向FeCl2溶液(含少量FeBr2杂质)中,加入适量氯水,再加CCl4萃取分液 | 除去FeCl2溶液中的FeBr2 |
A. A B. B C. C D. D
【题目】如图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d。符合上述实验结果的盐溶液是
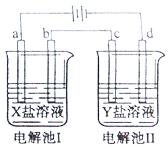
选项 | X | Y |
A. | CuSO4 | AgNO3 |
B. | AgNO3 | NaCl |
C. | FeSO4 | Al2(SO4)3 |
D. | MgSO4 | CuSO4 |
A.AB.BC.CD.D