题目内容
【题目】校化学兴趣小组的同学运用滴定法对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定,请回答下列问题:
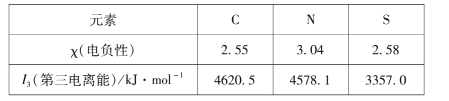
(1)用分析天平准确称取该样品5.360g,全部溶于水配制成1000.0mL的溶液。用碱式滴定管取其中20.00mL放在锥形瓶中,滴加几滴酚酞做指示剂。用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视着____________________。滴定终点的现象是_________________________。
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是___________ (填写序号)
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示:则滴定终点的读数为_____mL。
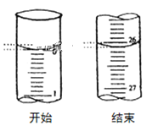
【答案】锥形瓶内溶液颜色变化 由红色变成无色,且半分钟不褪色 D 26.10
【解析】
(1)根据锥形瓶中溶液颜色变化判断终点;滴定前锥形瓶中为氢氧化钠和酚酞,溶液为红色,达到终点时变为无色;
(2)根据c(待测)═![]() 分析误差;
分析误差;
(3)滴定管大刻度在下方,最小读数为0.01mL,据此结合图示分析;
(1)滴定时要根据锥形瓶中溶液颜色变化判断终点,所以眼睛应该观察锥形瓶内溶液颜色变化;滴定前锥形瓶中为氢氧化钠和酚酞,溶液为红色,达到终点时变为无色,则滴定终点的现象是溶液由红色变成无色,且半分钟不褪色,
故答案为:锥形瓶内溶液颜色变化;由红色变成无色,且半分钟不褪色;
(2)根据c(待测)═![]() 分析,
分析,
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液,标准液的浓度偏小,造成消耗的V(标准)偏大,则测定c(NaOH)偏高,故A错误;
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥,待测液的物质的量不变,对V(标准)无影响,测定c(NaOH)无影响,故B错误;
C.酸式滴定管在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,测定c(NaOH)偏高,故C错误;
D.读取盐酸体积时,滴定结束时俯视读数,造成V(标准)偏小,测定的c(NaOH)偏低,故D正确;
故答案为:D;
③滴定管能够读到0.01mL,由图可知滴定后读数为26.10mL,
故答案为:26.10。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案【题目】如图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d。符合上述实验结果的盐溶液是
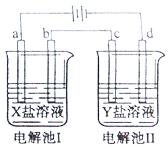
选项 | X | Y |
A. | CuSO4 | AgNO3 |
B. | AgNO3 | NaCl |
C. | FeSO4 | Al2(SO4)3 |
D. | MgSO4 | CuSO4 |
A.AB.BC.CD.D