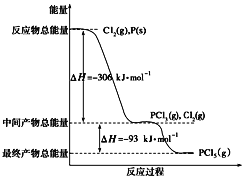
题目内容
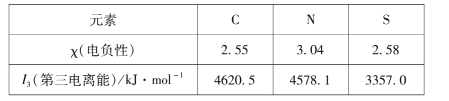
【题目】某工厂采用如图装置处理化石燃料开采、加工过程产生的H2S废气,已知电解池中的两个电极均为惰性电极。下列说法错误的是
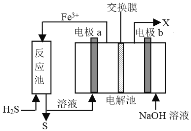
A.电极a电极反应式为Fe2+- e-=Fe3+
B.该装置能实现由H2S转化为S和H2
C.若交换膜为质子交换膜,则NaOH溶液的浓度逐渐变大,需要定期更换
D.若交换膜为阳离子交换膜,b电极区会产生红褐色沉淀
【答案】C
【解析】
电极a有Fe3+生成,则a为电解池阳极,b为电解池阴极;Fe3+在反应池中与硫化氢发生氧化还原反应,还原产物Fe2+可再进入电解池中放电;
A.电极a有Fe3+生成,则a为电解池阳极,发生氧化反应,电极反应为:Fe2+- e-=Fe3+,故A正确;
B.反应池中Fe3+与硫化氢发生氧化还原反应,生成Fe2+、硫、氢离子,发生的反应为H2S +2Fe3+ = 2Fe2+ +S↓+2H+,故B正确;
C.阴极上,水电离的氢离子放电生成氢气,若交换膜为质子交换膜,则氢离子会向氢氧化钠溶液移动,消耗的氢离子与迁移的氢离子的数量相同, NaOH溶液的浓度不变,故C错误;
D.若交换膜为阳离子交换膜,Fe3+会向阴极移动,与氢氧根离子生成红褐色沉淀Fe(OH)3,故D正确;
答案选C。

 导学全程练创优训练系列答案
导学全程练创优训练系列答案【题目】如图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d。符合上述实验结果的盐溶液是
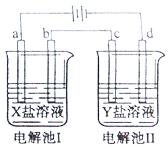
选项 | X | Y |
A. | CuSO4 | AgNO3 |
B. | AgNO3 | NaCl |
C. | FeSO4 | Al2(SO4)3 |
D. | MgSO4 | CuSO4 |
A.AB.BC.CD.D
【题目】运用化学反应原理研究碳、氮的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)反应ⅠFe(s)+CO2(g) ![]() FeO(s)+CO(g) ΔH1,平衡常数为K1;
FeO(s)+CO(g) ΔH1,平衡常数为K1;
反应ⅡFe(s)+H2O(g) ![]() FeO(s)+H2(g) ΔH2,平衡常数为K2;
FeO(s)+H2(g) ΔH2,平衡常数为K2;
在不同温度K1、K2值如下表:
700 ℃ | 900 ℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
①由表中判断,反应Ⅰ为中ΔH1______ (填“<”或“=”或“>”) 0。
②反应CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH平衡常数为K,则K=________(用K1和K2表示)。
CO(g)+H2O(g) ΔH平衡常数为K,则K=________(用K1和K2表示)。
③能判断CO2(g)+H2(g) ![]() CO(g)+H2O(g)达到化学平衡状态的依据是________(填字母)。
CO(g)+H2O(g)达到化学平衡状态的依据是________(填字母)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO)=c(CO2)
E.容器内的气体密度不变 F.混合气体的平均摩尔质量不变。
(2)在不同温度和压强下合成氨,起始时投入氮气和氢气的物质的量分别为1mol、3mol。平衡时混合物中氨的体积分数与温度的关系如图。
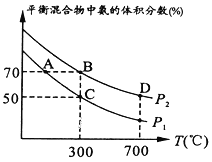
①P1_______P2 (填“>”“=” “<”或“不确定”,)。
②C点H2的转化率为________。